Способы подготовки и очистки газов
В основную группу процессов очистки и переработки газов входят следующие:
- Сепарация конденсата – отделение жидкой фазы, выносимой газом из скважины;
- Сепарация капельной жидкости после отделения основной её части на ступени сепарации конденсата;
- Отделение вредных примесей – сероводорода и диоксида углерода;
- Глубокая осушка газа от влаги охлаждением до точки росы (минус 30 °С и ниже);
- Отбензинивание газа - удаление из него углеводородовот пропана и выше;
- Извлечение гелия.
К вредным примесям газа относятся ядовитые и корозионно-активные серосодержащие соединения и негорючие инертные газы, снижающие теплоту сгорания углеводородного газа.
В общем случае в углеводородном газе могут содержаться такие серосодержащие соединения, как сероводород, серооксид углерода, сероуглерод, меркаптаны, а в газовом конденсате – также сульфиды и дисульфиды.
В состав инертных газов входят диоксид углерода, азот и гелий.
1. СПОСОБЫ ОЧИСТКИ УГЛЕВОДОРОДНЫХ ГАЗОВ ОТ Н2S, СO2 И МЕРКАПТАНОВ
Для очистки природного газа от Н2S и С02 применяют различные процессы, которые можно разбить на следующие группы:
• хемосорбционные процессы, основанные на химическом взаимодействии Н2S и С02 с активной частью абсорбента;
• процессы физической абсорбции, в которых извлечение кислых компонентов происходит за счет их растворимости в органических поглотителях;
• комбинированные процессы, использующие одновременно химические физические поглотители;
• окислительные процессы, основанные на необратимом превращении поглощенного сероводорода в серу;
• адсорбционные процессы, основанные на извлечении компонентов газа твердыми поглотителями-адсорбентами (молекулярные сита, активированные угли и др.)
Выбор процесса очистки природного газ от сернистых соединений зависит от многих факторов, основными из которых являются: состав и параметры сырьевого газа, требуемая степень очистки и область использования товарного газа, наличие и параметры энергоресурсов, отходы производства и др.
Анализ мировой практики, накопленной в области очистки природных газов, показывает, что основными процессами для обработки больших потоков газа являются абсорбционные с использованием химических и физических абсорбентов и их комбинации. Окислительные и адсорбционные процессы применяют, как правило, для очистки небольших потоков газа, либо для тонкой очистки газа.
К абсорбентам, используемым в промышленности, предъявляются следующие требования:
• недефицитность
• высокая поглотительная способность
• низкая упругость пара
• низкая вязкость
• низкая теплоемкость
• нетоксичность
• селективность (при селективной абсорбции)
Из хемосорбентов наиболее широко применяют алканоламины. Использование химических растворителей основано на химической реакции между хемосорбентом и кислыми компонентами. Максимальная поглотительная способность водных растворов химических абсорбентов ограничена стехиометрией.
Наиболее известными этаноламинами, используемыми в процессах очистки газа от Н2S и С02 являются:
• моноэтаноламин (МЭА)
• диэтаноламин (ДЭА)
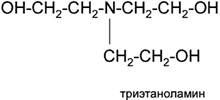
• триэтаноламин (ТЭА)
• дигликольамин (ДГА)
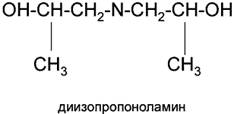
• диизопропаноламин (ДИПА)
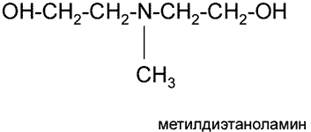
• метилдиэтаноламин (МДЭА)
Наибольшее практическое применение получили моно- и диэтаноламин. Использование ДЭА особенно целесообразно в тех случаях, когда в исходном газе наряду с Н2S и С02 содержатся COS и СS2, которые вступают в необратимую реакцию с МЭА, вызывая его значительные потери. Для селективного извлечения Н2S в присутствии СO2 используют третичный амин - метилдиэтаноламин.
В физических процессах извлечение кислых компонентов из газа происходит за счет физического растворения их в применяемом абсорбенте. При этом, чем выше парциальное давление компонентов, тем выше их растворимость. Из физических абсорбентов промышленное применение для очистки газов нашли такие, как:
• метанол
• N-метилпирролидон
• алкиловые эфиры полиэтилен гликоля
• пропиленкарбонат
Очистка углеводородных газов этаноламинами
Физико-химические свойства этаноламинов и их водных растворов
Алканоламины (аминоспирты, оксиамины) можно рассматривать как производные аммиака, в котором один или несколько атомов водорода замещены на спиртовой радикал или спиртовой и углеводородный.
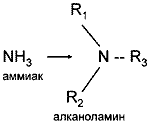
где R - спиртовой радикал, например С2Н4ОН; R2, R3 - либо спиртовой, либо углеводородный радикал, либо Н+.
По степени замещения атомов водорода при атоме азота алканоламины делятся первичные, вторичные и третичные.
Первичные
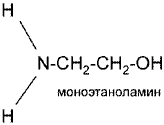
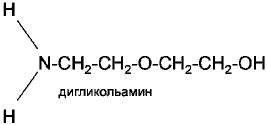
Вторичные
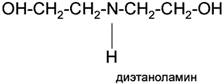
Третичные
Алканоламины содержат по крайней мере одну гидроксильную (-ОН) и одну аминогруппу
![]()
Присутствие гидроксильной группы снижает давление насыщенных паров и повышает растворимость амина в воде, а аминогруппа придает водным растворам щелочность, необходимую для взаимодействия с Н2S и СO2, которые в водной среде диссоциируют с образованием слабых кислот.
Алканоламины - это бесцветные, вязкие, гигроскопичные жидкости, смешивающиеся с водой и низкомолекулярными спиртами во всех соотношениях; они почти нерастворимы в неполярных растворителях.
Безводные алканоламины применяют, как правило, в виде водных растворов. Концентрация амина в растворе может изменяться в широких пределах, ее выбирают на основании опыта работы и по соображениям коррозии оборудования.
Химизм взаимодействия Н2S, CО2 и других компонентов с этаноламинами.
Алканоламины, будучи щелочами, легко вступают в реакцию с кислыми газами Н2S (СO2), образуя водорастворимые соли. При этом протекают следующие реакции:
Н2S + (Амин) <—> (Амин х Н)++НS+ (мгновенно)
СO2+2х (Амин) <—> (Амин х Н)++ (Амин х СОО)- (быстро)
СO2+Н2O <—> Н2СO3 (медленно)
Н2СO3 <—> Н++ НСO3- (быстро)
НСO3- <—> Н++ СO3- (быстро)
(Амин) + Н+ <—> (Амин х Н)+ (быстро)
Все амины реагируют с Н2S одинаковым образом с образованием гидросульфида или сульфида амина, причем реакция классифицируется как мгновенная.
Первичные и вторичные амины могут реагировать с СO2 с образованием карбамата (соли замещенной карбаминовой кислоты - амин*СОО-*Н+), которая трактуется как быстрая реакция второго порядка. Кроме того, с СO2 образуются карбонаты и бикарбонаты аминов, но образованию их предшествует медленная реакция растворения СO2 в воде с образованием угольной кислоты Н2СO3. Считается, что при умеренных степенях карбонизации амина (до 0,5 моль СO2/моль амина) преимущественно протекает быстрая реакция образования карбамата. Карбаматы аминов - нестойкие соединения и в слабощелочной среде они медленно разлагаются с образованием бикарбоната (на примере вторичного амина):
R2NCOOR2NH2 + H2O <—> R2NH + R2NH2HCO3
где R – HOCH2CH2
У третичного алканоламина нет подвижного атома Н+ в аминовои группе ( N -), поэтому становится невозможным протекание прямой и быстрой реакции с СO2 по карбаматному типу, а взаимодействие осуществляется через предварительную и медленную стадию образования и диссоциации угольной кислоты:
СО2+Н2О <—> Н2СО3; Н2СО3 <—> Н++НСО3-
(Амин)+ Н++ НСО- <—> (Амин х Н)+х НСO3-
Конечными продуктами реакции являются бикарбонат и карбонат. Таким образом, разница в скоростях реакций третичных аминов с Н2S (мгновенная реакция) и СO2 (медленная реакция) гораздо значительнее, чем для первичных и вторичных аминов. Это позволяет использовать на практике третичные амины для селективного извлечения Н2S из смесей его с СO2.
Реакционная способность алканоламинов изменяется в ряду: первичные > вторичные > третичные и коррелируется с их щелочностью. Диоксид углерода образует с алканоламинами различные побочные продукты. Механизм их образования изучен не полностью.
Часть из них на стадии регенерации абсорбента разрушается и снова выделяет алканоламин, другая часть нерегенерируется, что является одной из причин потерь амина. Наибольшее количество нерегенерируемых соединений характерно для первичных алканоламинов.
Меркаптаны, будучи кислотами, обратимо реагируют с алканоламинами с образованием водородрастворимых меркаптидов.
(Амин)+RSН <—> (Амин х Н)+х RS-
где R - углеводородный радикал.
Реакции предшествует растворение меркаптанов в абсорбенте и диссоциация на ионы
Н2O
РSН <—> RS- + Н+
Кислотность меркаптанов значительно ниже, чем Н2S и СO2, вследствие чего последние вытесняют меркаптаны из их соединения с аминами. Меркаптиды - нестойкие соединения, легко разрушающиеся при нагревании.
На растворимость меркаптанов в алканоламинах значительное влияние оказывает наличие СO2 в растворе. Равновесная растворимость С2Н5SН в аминах при наличии СO2 в растворе в количестве 2 г/л (глубокая регенерация) снижается в 2,5 - 4 раза. С увеличением содержания СO2 в растворе растворимость С2Н5SН приближается к растворимости его в воде. При этом характер изменения растворимости соответствует изменению рН раствора.
Таким образом, на промышленных установках аминовой очистки газа от Н2S и СO2 не представляется возможным одновременно полностью очистить газ от меркаптанов.
Сероокись углерода в водных растворах аминов гидролизуется
СOS+Н2S <—> СO2+Н2S.
Образовавшиеся Н2S и СO2 реагируют с аминами. Однако ввиду того, что в исходном газе концентрация СОS по сравнению с Н2S и СO2 невелика, прямая реакция никогда не доходит до конца. Лимитирующая стадия процесса - растворение в абсорбенте.
Сероокись углерода может непосредственно вступать в реакции с первичными и вторичными аминами с образованием тиокарбаматов (аналогично СO2). СOS способна вступать также в другие реакции с аминами, механизм которых изучен не до конца. При этом с первичными аминами образуются нерегенерируемые продукты: вторичные и третичные амины реагируют обратимо.
При создании в абсорбенте аминовой очистки газа зоны гидролиза СОS, состоящей из 6 - 10 практических тарелок, при температуре 60 - 80 °С можно извлечь из газа значительную (до 80 %) часть сероокиси углерода.
Схемы процесса очистки газа водными растворами аминов
Поступающий на очистку газ проходит восходящим потоком через абсорбер навстречу потоку раствора. Насыщенный кислыми газами раствор, выходящий с низа абсорбера, подогревается в теплообменнике регенерированным раствором из десорбера и подается наверх его.
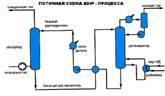
После частичного охлаждения в теплообменнике регенерированный раствор дополнительно охлаждается водой или воздухом и подается наверх абсорбера. Тепло, необходимое для регенерации насыщенного раствора, сообщается раствору в рибойлерах, обогреваемым глухим паром низкого давления. Кислый газ из десорбера охлаждается для конденсации большей части содержащихся в нем водных паров. Этот конденсат-флегма непрерывно возвращается обратно в систему, чтобы предотвратить увеличение концентрации раствора амина. Обычно эту флегму подают в верх десорбера несколько выше входа насыщенного раствора для конденсации паров амина из потока кислого газа. В схеме предусмотрен экспанзер (выветриватель) при Р очистки >1,6МПа, где за счет снижения давления насыщенного раствора выделяются физически растворенные в абсорбенте углеводороды и частично сероводород и диоксид углерода.
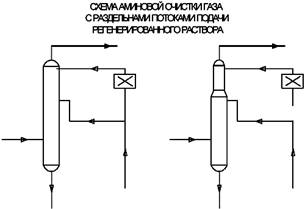
Экспанзерный газ после очистки используется в качестве топливного газа или компримируется и подается в поток исходного газа. Широкое распространеие в промышленности получила схема с раздельными потоками подачи в абсорбер регенерированного раствора одинаковой степени регенерации. 70-80% раствора подается в середину абсорбера, а остальное количество - на верх.
Это позволяет снизить затраты энергии на перекачку раствора, уменьшить металлоемкость абсорбера (верхняя часть меньшего диаметра), а также повысить степень извлечения СОS (в случае его наличия в газе) за счет подачи среднего потока раствора с более высокой температурой и осуществления реакции гидролиза СОS.
очистка газ углеводород гелий
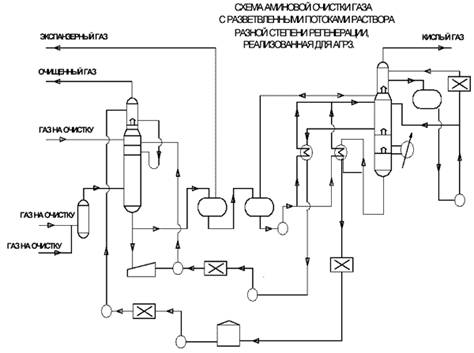
В схеме аминов и очистки газа с высоким содержанием кислых компонентов подача раствора в абсорбер осуществляется двумя потоками, но разной степени регенерации. Частично регенерированный раствор из десорбера подается в среднюю секцию абсорбера. Глубокой регенерации подвергается только часть раствора, которая подается на верх абсорбера для обеспечения тонкой очистки газа. Такая схема позволяет по сравнению с обычной схемой до 10-15% снизить расход пара на регенерацию раствора.
При очистке газа с высоким содержанием кислых компонентов целесообразно осуществить двойное расширение (выветривание) насыщенного амина при разном давлении. На первой ступени при давлении 1,5-2 МПа из раствора выделяется основное количество растворенных углеводородов, что обеспечивает в дальнейшем низкое (< 2%) содержание их в кислом газе - это гарантирует высокое качество получаемой серы.
Этот поток экспанзерного газа либо используется после очистки от сероводорода в качестве топливного газа, либо компримируется и смешивается с основным потоком очищаемого (сырого) газа.
На второй ступени при давлении, близком к атмосферному, без тепловой регенерации выделяется из раствора поток кислого газа, который, после выделения из него воды и охлаждения, может быть непосредственно направлен на установку получения серы. За счет этого сокращается до 10% расход пара на регенерацию насыщенных растворов амина.
В схеме дополнительно устанавливается насос для подачи насыщенного раствора из второго выветривателя в десорбер. При очистке газа, содержащего Н2S и СO2, в абсорбере может быть предусмотрена зона поглощения и гидролиза СОS, состоящая из пяти-восьми тарелок, куда подается регенерированный раствор амина с повышенной температурой 70-80°С.
Выбор рабочего раствора
При выборе рабочего раствора для очистки газа, кроме доступности и цены алканоламина, руководствуются следующими положениями:
1. Первичные алканоламины более реакционноспособны, и их применение предпочтительнее. Кроме того, МЭА имеет низкую молекулярную массу и при одинаковой концентрации в растворе содержится больше молей амина, чем у других аминов.
2. Наличие СОS в газе исключает применение первичных алканоламинов из-за образования нерегенерируемых побочных продуктов и больших потерь амина. В этом случае предпочтителен ДЭА. При выборе амина необходимо также учитывать и другие продукты деградации амина.
З. Для селективного извлечения Н2S рекомендуют примерять третичные амины, в частности МДЭА. Также третичные амины применяют с целью снижения эксплуатационных затрат.
Обычные массовые доли аминов в растворе, используемых для очистки, %: МЭА 15-20, ДЭА 20-30, МДЭА 30-50.
Теплота абсорбции кислых газов различными аминами
| Теплота абсорбции кислых газов различными аминами. | |||
| Тип амина | Мол. вес амина | Теплота абсорбции, КДж/кг | |
| H2S | CO2 | ||
| МЭА | 61,09 | 1905 | 1920 |
| ДЭА | 105,14 | 1190 | 1510 |
| ДИПА | 133,19 | 1140 | 2180 |
| МДЭА | 119,17 | 1050 | 1420 |
Подобные работы: