Аналитический контроль качества титаната бария
Министерство образования Российской Федерации
Пермский государственный университет
Кафедра аналитической химии
Дипломная работа
тема: Аналитический контроль качества титаната бария
Пермь 2005
Введение
Титанат бария является диэлектрическим материалом, обладающим пьезоэлектрическими и сегнетоэлектрическими свойствами и большой диэлектрической проницаемостью. Он применяется в конденсаторах электрических, в пьезоэлектрических излучателях и приёмниках звука и УЗ, в качестве нелинейных элементов в оптических системах, электронике и вычислительной технике и т.д. В производстве керамических конденсаторов и позисторов более 90% керамики составляет титанат бария. В 2000-м году объем продаж электронной керамики находился в США на уровне 11,5 млрд. долларов, а в Японии на уровне 22,0 млрд. долларов. Более 50% электронной керамики составляет конденсаторная керамика с её ежегодным приростом в 10% в год, или 1,5 млрд. долларов США. Таким образом, для выпуска и целенаправленного применения титаната бария необходим контроль его качества как на стадии производства, так и использования. Нами опробован для этой цели атомно-эмиссионный метод анализа.
1. Литературный обзор
1.1 Способы получения
В мировом промышленном производстве титаната бария существуют два принципиально различных способа синтеза (1) исходных соединений – термический синтез, т.е. образование соединений в процессе твердофазной реакции при высоких температурах, и химический синтез, при котором соединения образуются при реакциях в растворах, а затем влага удаляется посредством прокалки, вымораживания и т.д. Оба требуют высоких температур и характеризуются следующими предельными возможностями: средний размер частиц материала 1-3 мкм, удельная поверхность порядка 1 кв.м/г, возможная толщина диэлектрика – 15 мкм, или, соответственно 0,7-1 мкм, 3 кв.м/г и 10 мкм. Предлагается процесс (с низкой температурой кристаллизации – всего 150 град. С), все технологические операции которого отработаны на укрупненных установках с производительностью ТБА 100 кг/год. В процессе отработки определены оптимальные режимные параметры, позволяющие при высокой чистоте продукта получать монодисперсный порошок с размером 0,1-0,3 мкм, удельной поверхностью 10 кв.м/г и возможной толщиной диэлектрика 6 мкм. При создании производства к установке будет приниматься серийное оборудование, изготовленное промышленностью РФ. Полученный титанат бария позволит повысить удельную емкость конденсаторов на 30-40% и снизить температуру спекания конденсаторной керамики. К методу термического синтеза относится производство спека титаната бария. Титанат бария синтезируют путем обжига смеси карбоната бария и диоксида титана. В промышленном варианте синтез проводят во вращающихся печах, аналогичных по конструкции широко применяемым в цементном производстве. Схема технологического процесса следующая. Карбонат бария и диоксид титана смешивают мокрым способом в шаровой мельнице, футерованной износостойкой резиной, высокоглиноземистыми мелющими телами. Одновременно со смешением происходит измельчение – помол смеси. Для ускорения реакций, происходящих при синтезе, и снижения температуры синтеза необходимо применять мелкодисперсное сырье, поэтому предпочтительно использование диоксида титана в кристаллической модификации анатаза, имеющего большую, чем рутил, дисперсность. Размолотая смесь (шликер) сливается из шаровой мельницы в контейнер, где непрерывно перемешивается во избежание расслоений. Из контейнера шликер мембранным насосом перекачивается в расходный бачок, снабженный устройством, регулирующим постоянный уровень шликера. Отсюда шликер дозирующим насосом подается во вращающуюся печь. В противоположную часть печи подается топливо (керосин), которое сгорает в смеси с воздухом. Вращающаяся печь имеет некоторый наклон (» 4° к горизонту), поэтому шликер, подаваемый в загрузочную часть печи, постепенно движется навстречу горящему факелу керосина, проходя интервал температур от комнатной до максимальной температуры обжига. Вращение печи вокруг своей оси способствует движению и перемешиванию обжигаемых материалов. Образование метатитаната бария по реакции
BaCO3 + TiO2 ® BaTiO3 + CO2
начинается при температуре » 800° С. При дальнейшем повышении температуры (» 1000° С) эта реакция сопровождается образованием ортотитаната бария
BaCO3 + BaTiO3 ® Ba2TiO4 + CO2.
При температуре начиная с 1100° С, при реакции метатитаната бария с диоксидом титана образуется «трититанат бария», точнее Ba6Ti17O40. Далее ортотитанат и «трититанат» взаимодействуют между собой с образованием конечного продукта – метатитаната бария (1200° С). При необходимости спек титаната бария может быть дополнительно размолот сухим способом. Изготовленный спек характеризуют следующими параметрами: насыпной массой (кг/л), молярным отношением оксидом BaO/TiO2, содержанием «свободного» оксида бария, количеством остатка, нерастворимого в соляной кислоте, содержанием примесей, удельной поверхностью. Насыпная масса (вес) свидетельствуют о надлежащей степени синтеза титаната бария, который по мере увеличения температуры синтеза спекается в относительно крупные гранулы (» 10 мкм). В зависимости от назначения спека его насыпная масса устанавливается в пределах 1,2 – 1,5 кг/л. Определение насыпной массы, производимое непосредственно на выходе печи, является эффективным экспресс – методом контроля качества спека. Соотношение оксидов BaO/TiO2, характеризующее стехиометрию полученного продукта, необходимо поддерживать в пределах 1,00 ± 0,02, однако для большинства современных материалов стехиометрия должна быть соблюдена более точно. Как правило, BaO/TiO2 = 0,99 – 1,00 или 1,00 – 1,01 в зависимости от назначения спека. Остаток, нерастворимый в HCl, является косвенным показателем содержания в спеке полититанатов, а также соединений бария с анионными примесями (например, сульфата бария, образующегося при наличии в исходном сырье серы в количестве нескольких десятых процента). Обычно стремятся к минимуму содержания в спеке нерастворимого остатка. Наличие посторонних фаз в спеке может быть также определено рентгенофазовым анализом. Разновидностью термического синтеза можно считать самораспространяющийся высокотемпературный синтез (СВС), или технологическое горение. Сущность этого метода заключается в том, что в качестве исходных берутся активные компоненты, приводящие к экзотермической реакции получения требуемого соединения. Работы по получению исходных веществ для конденсаторной керамики - BaTiO3 показали возможность применения метода СВС для их синтеза. Синтез BaTiO3 из смеси BaO2, Ti и TiO2 проходит при одновременном протекании трех экзотермических реакций:
BaO2 + 0,5TiO2 ® BaTiO3 + 536 кал/г;
y (BaO + TiO2) ® y BaTiO3 + 160,5 кал/г;
x (BaO2 + TiO2) ® x (BaTiO3 + 0,5O2) + 74,7 кал/г.
Соответствия состава и структуры получаемых продуктов заданным значениям можно добиться рациональным выбором соотношения компонентов и режима синтеза. Однако продукты получаются грубодисперсными и не имеют преимуществ против термически синтезированных соединений; в то же время для метода СВС необходимо применять более дорогое сырье. (1) Термический синтез не позволяет получить титанат бария, обладающий необходимыми свойствами: гомогенностью, высокой степенью синтеза при сравнительно невысоких температурах, малым размером частиц. По данным разных авторов, такой способ получения не обеспечивает также воспроизводимости свойств титаната бария от партии к партии. Это может объясняться как нарушением стехиометрии и загрязнением примесями во время помола, так и колебаниями степени дисперсности порошков. В связи с этим внимание исследователей многих стран было обращено на разработку новых методов синтеза титаната бария. Эти методы относятся к химическим методам синтеза. В литературе описано несколько вариантов оксалатного метода получения титаната бария, различающихся условиями выделения из водных растворов титанилоксалата бария и его термического разложения. Титанилоксалат бария BaC2O4TiO(C2O4) · 4H2O, или BaTiO(C2O4)2 · 4H2O, можно синтезировать взаимодействием хлоридов бария и титана со щавелевой кислотой на холоду или при нагревании до 60 – 80º С. В промышленных условиях титанилоксалат бария производят сливанием растворов хлорида титана и бария с нагретым до 80ºС раствором щавелевой кислоты или путем вливания раствора щавелевой кислоты в смесь хлоридов. Важное значение имеет режим термообработки титанилоксалата. При нагревании титанилоксалат бария сначала обезвоживается при 200 – 300º С, затем происходит его разложение (700º С) с образованием промежуточных соединений, которые при 1000º С превращаются в BaTiO3. режим прокалки оказывает решающее влияние на дисперсность полученного порошка: повышение температуры прокалки приводит к спеканию частиц и уменьшению удельной поверхности порошка от 3 – 4 м2/г до 1 – 2 мг2/г. такой титанат бария использовался для выращивания монокристаллов (1). Кисс и Магде синтезировали титанилоксалат бария при 20-часовом кипячении титаната бария, спеченного из смеси BaCO3 и TiO2, в 10%-ной щавелевой кислоте. Эти исследователи указывают на возможность регулирования размера частиц титаната бария путем прокалки титанилоксалата бария при разных температурах: при 650º С получаются 0,06÷0,1 мкм, при 825º С – 0,08÷0,15 мкм, при 975º С – 0,15÷0,2 мкм, при 1150º С – 0,3÷0,5 мкм. Однако, подчеркивая возможность получения очень мелких частиц при низких температурах, они не учитывают тот факт, что титанилоксалат бария полностью разлагается и переходит в BaTiO3 только при температурах выше 800º С, о чем свидетельствуют многие работы по изучению механизма разложения титанилоксалата бария. Титанат бария может быть получен также из других соединений бария и титана, выделенных из водных растворов. Так, Меркер прокалкой титанилтартрата бария Ba(TiO(C2H4O6)2) при 600º С синтезировал порошок BaTiO3 с частицами, проходящими через сито 100 меш., пригодный для выращивания монокристаллов. Термическим разложением при 1000 – 1100º совместно осажденных соединений бария и титана, выделенных из растворов карбонатом аммония, получен BaTiO3 с размером частиц менее 1 мкм. Керамика из такого титаната бария имеет диэлектрическую проницаемость 1700 – 2000, близкую к диэлектрической проницаемости оксалатного BaTiO3.(2) Известен также способ синтеза титаната бария методом золь-гель. Этот способ основан на переводе свежеосажденных соединений (обычно гидроксидов) в коллоидное состояние. Для образования золей используют длительную пептизацию осадков в воде, кислотах, растворах солей или электроионизацию (электродиализ). Удаление воды из золей с переводом их в гели, а затем в сыпучие порошки проводится сушкой или экстракцией воды органическими растворителями с последующей прокалкой. Метод дает возможность получать мелкодисперсные порошки соединений заданного состава. Он может быть подразделен на две разновидности: с использованием неорганических исходных материалов с использованием металлорганических соединений – алкоголятов (алкоксидный синтез).
По технологии с использованием неорганических веществ возможно получать титанаты щелочноземельных металлов; делались попытки получения твердых растворов соединений. Для синтеза титаната бария к водному раствору хлорида титана при непрерывном перемешивании добавляют водный раствор осадителя (NH4OH, NaOH и др.) Затем к суспензии образующегося гидроксида добавляют при перемешивании водный раствор, содержащий катионы Ba2+ (в частности BaCl2). Образующийся осадок фильтруют, промывают, высушивают и прокаливают. Процесс может быть выражен следующей схемой:
TiOCl2 · nH2O + Ba2+ + 2Cl- + 2NH4OH → y BaO · TiO2 · nH2O + 2NH4Cl
Полученный после промывки и сушки порошок имеет высокую удельную поверхность, до 200 м2/г; величина Sуд резко уменьшается с повышением температуры и времени термообработки. Уменьшении Sуд происходит как за счет увеличения размера частиц, так и за счет образования агломератов частиц. (1) По современным представлениям, высокая чистота, структура и субмикронная дисперсность материалов определяют электрофизические параметры и стабильность изделий на их основе. Наиболее перспективными для синтеза подобных материалов являются методы, основанные на химических реакциях в жидкой фазе с выделением продуктов реакции в осадок. Особенность этих методов заключается в том, что синтез материалов осуществляют как «интегрирование» зерен материала, начиная с молекулярного уровня. Наиболее интересной в этом отношении является золь – гель технология из алкоксидов металлов, позволяющая получать как простые, так и сложные композиционные материалы. Титанат бария является основой для большинства керамических конденсаторных материалов. Технология алкоксидного синтеза включает в себя следующие стадии:
- приготовление смешанных сложных растворов в органическом растворителе, включающих в себя все элементы будущих оксидных соединений в необходимой пропорции;
- гидролиз растворов;
термообработка продуктов гидролиза. Золь – гель метод применяли в реакциях гидролиза: а) смеси алкоксидов титана и бария, б) двойных алкоксидов титана и бария, в) алкоксида титана в растворе гидроксида бария. Бутоксид титана Ti(OR)4 (квалификации «чистый» ) перегоняли под вакуумом. Изопропоксид бария Ba(i-C3H7O)2 синтезировали растворением металлического бария в изопропиловом спирте (1). Реакцию проводили в атмосфере сухого аргона в колбе с обратным холодильником, снабженным трубкой с хлоридом кальция (во избежание гидролиза). Изопропиловый спирт обезвоживали кипячением над свежепрокаленным оксидом кальция и последующей двукратной перегонкой. Синтез проводили в избытке спирта при температуре 30 – 40º С. Для получения титаната бария BaTiO3 смешивали расчетные по стехиометрии количества Ba(OR)2 и Ti(OR)4, затем проводили гидролиз деионизованной водой:
Ba(i-C3H7O)2 + Ti(OC4H9)4 + 3H2O → BaTiO3 + 2C3H7OH + 4C4H9OH (1)
Белый рыхлый порошок отделяли от раствора центрифугированием или фильтрованием, высушивали на воздухе.
Вторая серия образцов титаната бария была получена гидролизом двойных алкоксидов MIIMIV(OR)x. Навеску металлического бария вводили в рассчитанное по стехиометрии количество бутоксида титана Ti(OC4H9)4, растворенного в бутиловом спирте (2):
Ba + Ti(OC4H9)4 + 2C4H9OH → BaTi(OC4H9)6 + H2↑. (2)
Реакция начиналась сразу после небольшого нагрева смеси, процесс шел в токе предварительно осушенного инертного газа. В результате реакции (2) образовывался мутный с желтоватым оттенком раствор, добавление к которому деионизованной воды приводило к интенсивному осаждению белого творожистого осадка. Полученный осадок сушили и прокаливали при 600 – 650º С на воздухе. Проведено исследование влияния условий гидролиза: мольного соотношения алкоксид: вода, температуры воды и рН – на структуру и состав титаната бария. Изучение структуры и фазового состава синтезированного титаната бария осуществляли с помощью электронного микроскопа УЕМ–120, растрового УМ-2, электронографа ЭРМ-100. По результатам исследований установлено, что минимальные размеры структурных элементов BaTiO3 составляют (30 – 50) · 10-3 мкм. Синтез титаната бария гидролизом алкоголята титана в растворе гидроксида бария осуществлялся по следующей схеме:
Ti(OR)4 + 4H2O + Ba2+ + 2(OH)ˉ →
Ti(OH)62- + Ba2+ + 4ROH → BaTiO3 + 4ROH + 3H2O
Раствор алкоксида титана (тетра-н.-бутоксититан) в изопропиловом спирте вводили в раствор гидроксида бария при интенсивном перемешивании, реакционную смесь выдерживали при 80 – 90º С в течение 2 ч. Затем следовали стадии вызревания осадка, фильтрования, сушки и прокаливания. Выбор гидроксида бария определен тем, что для протекания реакции образования метатитаната бария требуется щелочная среда. Концентрация алкоксида титана в изопропиловом спирте должна быть не более 100 г/л, так как исследования показали, что использование более высоких концентраций уменьшает соотношение BaO : TiO2 в готовом продукте. При низких температурах получаются кислые титанаты, увеличение температуры до 85 – 90º С позволяет получать титанат бария стехиометрического состава. Интенсивное перемешивание, быстрое введение алкоксида способствуют получению мелкодисперсного аморфного продукта. Порошки титаната бария полидисперсны; данные, полученные электронной микроскопией, позволяют определить, что размер единичных частиц составляет не более 0.5, а агрегатов – не более 5 мкм. Анализ дифрактограмм порошков, высушенных на воздухе и в вакууме при температуре 100 – 250º С, показал, что происходит формирование кристаллической структуры титаната бария. При сушке титаната бария на воздухе параллельно идет образование карбоната бария, резко снижающего выход стехиометрического продукта. Титанат бария, высушенный под вакуумом, имел четкую кристаллическую структуру перовскита, не содержащую карбоната бария. (3) Гидротермальный метод основан на реакциях гетерогенного взаимодействия, протекающих в специальных условиях между гидроксидами или оксидами титана, находящимися в твердой фазе, и ионами металлов, присутствующими в растворах солей или оснований. В качестве специальных условий выступают высокая температура (200 – 400º С) и высокое давление ( до 300 – 500 атм), т.е. реакция проходит в автоклавах. При использовании гидроксидов образование титаната бария описывается реакцией:
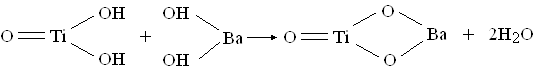
Исследование кинетики этой реакции показывает, что получение BaTiO3 происходит без образования промежуточных фаз. Для выделения полученного соединения необходима сушка или термообработка осадка. (1) Также гидротермальным методом в щелочном водном растворе Ba(NO3)2 и Ti(OC4H9)4 при 240º С синтезирован тетрагональный BaTiO3. Методами рентгенодифрактометрии, ДСК и ИК – спектроскопии исследовано влияние щелочности, концентрации нитрат- ионов и реакционной способности титанового источника на образование, размер частиц и морфологию продукта. Установлено, что при оптимальной концентрации КОН (1,0 М) BaTiO3 является наиболее устойчивой фазой в ряду BaO – TiO2. Нитрат- ион играет положительную роль в образовании и росте качественных кристаллов BaTiO3. Высокие реакционные способности титановых источников облегчают образование тетрагонального продукта. (4) Методами дифференциальной сканирующей калориметрии, термогравиметрии и рентгенографии при нагревании в интервале температур 20 – 900º С изучено получение BaTiO3 совместным пиролизом резинатов бария и титана. Определен фазовый состав продуктов постадийной термообработки. Показано, что в процессе совместного пиролиза резинатов бария и титана при температуре больше 600º С образуется метатитанат бария.(5) Химический синтез исходных соединений не исчерпывается перечисленными методами.
Выбор того или иного метода синтеза определяется технико-экономическими соображениями в каждом конкретном случае. (1)
1.2 Способы идентификации BaTiO3
Рассмотрим методы определения бария и титана в титанате бария (6).
1. Гравиметрически – фотометрический метод
Анализ титаната бария основан на гравиметрическом сульфатном методе определения бария. Чтобы предупредить соосаждение титана, последний удерживали в растворе лимонной кислотой. Определение титана проводили дифференциальным фотометрическим методом, используя его перекисный комплекс. Для перевода пробы в раствор применили сплавление. В качестве плавня использовали смесь тетраборнокислого и углекислого натрия.
Результаты анализа препаратов представлены в таблице. Время выполнения полного анализа 15 часов.
титанат барий диэлектрический эксперимент
| Определяемый компонент | Найдено компонента
| Стандартное отклонение
| Ошибка единичного определения, % |
BaOTiO2 | 55,18 31,40 | 0,54 0,24 | 2,62 1,93 |
Применяемые реактивы и растворы.
Аммоний йодистый, ГОСТ 3764-64 ч.д.а., 10%-ный раствор
Аммоний сернокислый, ГОСТ 3769-60, ч.д.а., 1%-ный раствор
Вода дистиллированная, ГОСТ 6709-53
Лимонная кислота, МРТУ 6-09-3840-67, ч.д.а., 15%-ный раствор
Натрий тетраборнокислый, ГОСТ 4199-66, ч.д.а.
Натрий углекислый безводный, ГОСТ 83-63, х.ч.
Серная кислота, ГОСТ 4204-66, х.ч., концентрированная и 1%-ный (по объему) раствор
Соляная кислота, ГОСТ 3118-67, х.ч., концентрированная, разбавленная 1:1, 15%-ный (по объему), 0,1 и 0,01н растворы.
Титан четыреххлористый, МРТУ 609-2363-65, х.ч.
Уксусная кислота, ГОСТ 61-51 х.ч. Стандартный раствор титана, содержащий 0,5 мг TiO2 в 1 мл. Готовят из четыреххлористого титана следующим образом: 7 мл 10М раствора четыреххлористого титана приливают к 100 мл концентрированной соляной кислоты, переносят в мерную колбу вместимостью 200 мл и доводят до метки 15%-ным раствором соляной кислоты. Содержание двуокиси титана в полученном растворе устанавливают гравиметрически купфероновым методом.
Описание определения В платиновый тигель помещают 2 г смеси для сплавления и ставят его в разогретую до 900º печь для получения расплава. После охлаждения тигля помещают в него навеску пробы 0,2 г, взятую с точностью 0,0002 г. Тигель накрывают крышкой и сплавляют при 900 – 1000º в течение 10 – 15 минут. Охлаждают тигель (застывший плав должен быть прозрачным) и выщелачивают плав 40 – 50 мл соляной кислоты (1:1) при нагревании. Полученный раствор переносят в мерную колбу вместимостью 100 мл и доводят объем раствора до метки (раствор А).
Определение барияПомещают 50 мл раствора А в стакан вместимостью 300 мл, прибавляют 25 мл раствора лимонной кислоты, 15 мл раствора йодистого аммония, нагревают раствор до кипения, прибавляют 50 мл раствора сернокислого аммония и нагревают на водяной бане до тех пор, пока осадок хорошо не осядет. Осадок фильтруют через фильтр «синяя лента», промывают 5 – 6 раз раствором серной кислоты (до отрицательной реакции на Сl-) и затем 1 – 2 раза водой. Осадок с фильтром помещают во взвешенный платиновый тигель, высушивают, обугливают и прокаливают при температуре 900º до постоянного веса. Содержание окиси бария в пробе X1 (%) рассчитывают по формуле:
![]() ,
,
где a – вес прокаленного осадка, г; b – привес контрольного опыта, г;
0,6569 – фактор пересчета BaSO4 на BaO; g – навеска вещества, г.
Определение титана Помещают 10 мл раствора А в мерную колбу вместимостью 50 мл, прибавляют 5 мл раствора перекиси водорода и доводят раствор до метки 15%-ным раствором соляной кислоты. Измеряют оптическую плотность полученного раствора на фотоэлектроколориметре ФЭК-56 со светофильтром №4 в кюветах с толщиной слоя 1 см по отношению к раствору двухромовокислого калия. По калибровочному графику находят содержание титана в растворе Содержание двуокиси титана в пробе X2 (%) рассчитывают по формуле:
![]() ,
,
где a – содержание двуокиси титана, найденное по калибровочному графику, г; g – навеска вещества, г.
Построение калибровочного графика Отбирают от 6 до 12 мл раствора, содержащего 0,5 мг/мл двуокиси титана, в мерные колбы вместимостью 50 мл, прибавляют 5 мл раствора перекиси водорода и доводят до метки 15%-ным раствором соляной кислоты. Измеряют оптическую плотность растворов по отношению к раствору двухромовокислого калия, как описано при определении содержания титана. По полученным данным строят калибровочный график в координатах: оптическая плотность – количество двуокиси титана (мг). Существуют и современные методы исследования состава титаната бария.
Дифракция медленных электронов и растровой электронной микроскопии.(7) Авторы данной работы исследовали состав поверхности кристаллов сложного оксида BaTiO3 в температурном интервале от комнатной (tk) до 1200º С.
Методика Объектами исследования служили естественные грани монокристаллов BaTiO3 двух партий, различающихся по содержанию примесей. Кристаллы помещали в вакуумную камеру электронного спектрометра «Вариан» с цилиндрическим зеркальным анализатором (разрешения 1,5 эВ) и рабочим давлением не выше 10-8 Па для получения картин дифракции электронов. В ходе экспериментов квадрупольным масс-спектрометром регистрировались газы, выделяющиеся из исследуемых объектов. Нагрев кристаллов осуществляли молибденовым нагревателем, не дававшим помех при регистрации оже-спектров во время нагрева. Температуру поверхности определяли термопарой, а выше 900º С - пирометром. Отношения амплитуд оже-сигналов Ba (584 эВ), Ti (380 эВ), О (509 эВ): АBa/ATi, AO/ATi были приняты за меру отношений концентраций элементов в BaTiO3. Эталонные отношения, отвечающие стехиометрии, получены экспериментально на вакуумных сколах и после снятия поверхностных слоев кристаллов ионной бомбардировкой, а также из расчетов по методу факторов относительной элементной чувствительности. Эти значения составили соответственно: 0,46±0,02 (Ba/Ti), 2,8±0,1 (О/Ti) для BaTiO3.
Экспериментальные результаты Температура tk - 400º С. Химический состав поверхности BaTiO3 зависит от условий роста. В первой партии он характеризуется избытком бария (АBa/ATi = 0,8), во второй партии – избытком титана (АBa/ATi = 0,1 – 0,2). Прогрев всех кристаллов при 400º С в течение 3-х часов и охлаждение до tk приводит к потемнению кристаллов вследствие начавшегося восстановительного процесса.
Температура 600 - 800º С . После 2-х часового отжига при 800º С и охлаждении до tk катионный состав BaTiO3 приближается к стехиометрическому.
Температура 800 - 1100º С. После отжига кристаллов BaTiO3 в этом интервале температур и охлаждения до tk состав поверхности постепенно начинает изменяться в сторону избытка титана. Для первой партии АBa/ATi = 0,5 и 0,38 для 830 и 1100º соответственно
Температура свыше 1100º С. Анализ оже-спектров и наблюдение микроструктуры поверхности показывают, что на поверхности образуется новая фаза BaO · nTiO2 (n>1), ориентировочно растущая на грани.
Дифракция рентгеновской фотоэлектронной спектроскопии (РФЭС) и магнетохимии. (8) В данной работе исследован механизм процесса восстановления BaTiO3.
Титанат бария получали из титанилоксалата бария. Атомное отношение Ba/Ti= 1 ±0,003. Восстановление проводили в водороде от 600 - 1400º С. Получены образцы со степенями восстановления от 0,05 до 0,20 вес. %.
В ходе проведенного исследования было установлено, что рост степени восстановления BaTiO3 сопровождается увеличением концентрации ионов Ti3+, а продуктами восстановления являются ортотитанат бария (Ba2TiO4) и фазы Магнели. Из (2,3) методов обнаружено, что восстановление BaTiO3 (как керамики, так и монокристаллов) сопровождается нарушением однофазности образцов, однако полученные результаты не согласуются между собой.
На взгляд авторов (9), надежная интерпретация получаемых экспериментальных данных и построение адекватной физико – химической модели процесса восстановления BaTiO3, невозможны без знания фазовых соотношений в тройной системе
BaO – TiO2 – Ti2O3.
Проведен рентгеноструктурный анализ по порошковым данным (λ Cu, 11 отражений, R 0,0818) BaxTiO3, полученного методом соосаждения при избытке TiO2. Согласно химическому анализу, х = 0,992, что подтверждено уточнением из рентгеновских данных. Отмечено укорочение связи Ti – O в BaxTiO3 до 1,78 Ǻ и меньшее тетрагональное искажение по сравнению с BaTiO3, что приводит к понижению температуры Кюри до 90º С. (10) Обсуждаются способы определения состава пленок с помощью электронного зонда. Приведены примеры использования метода при исследовании вакуумных конденсаторов. Для полученного способа дискретного испарения конденсата титаната бария по пленке. Состав конденсатов титаната бария определяли из сравнения отношений интенсивностей характеристических линий BaLα, TiKα для пробы монокристаллического эталона. (11) Существующие методы контроля или очень дороги или требуют проведения дополнительных уточнений результатов, в частности по диаграммам состояния, или очень длительны и трудоемки ( весовой метод). Нами сделана попытка определения соотношения Ba:Ti в титанате бария атомно – эмиссионным методом.
3. Экспериментальная часть
3.1 Аппаратура, оборудование, реактивы
1. Титанат бария (BaTiO3) – стандартный образец предприятия (СОП) (предоставлен политехническим университетом).
2. Графитовый порошок.
3. Яшмовая ступка
4. Пластинка для ядерных исследований
5. Аналитические весы.
6. Спектрограф ДФС – 452.
7. Электроды графитовые.
8. Микрофотометр М – 274.
9. Спектропроектор СП – 2.
10. Фиксаж и проявитель стандартного состава.
3.2 Выбор оптимальных условий спектрографирования
Спектры фотографировали на спектрографе ДФС – 452 во втором порядке решетки 600 штр./мм с трехконденсорной системой освещения через промежуточную диафрагму высотой 5 мм при ширине щели 0,01 мм на фотопластинке «для ядерных исследований». Аналитический промежуток 3 мм. Условия проявления стандартные. Режим спектрографирования для Ba и Ti установлен предварительными исследованиями. Для выбора оптимальных условий возбуждения пробы исследовались различные режимы работы генератора УГЭ – 4 (полярность электродов «±», «– », «+», деление частоты – д/ч 2, д/ч 3, фаза поджига - 45÷130; сила тока и скорость поступления элементов в плазму). Для увеличения интенсивности линий исследовалось также влияние размера кратера электрода. Установлено, что наибольшее почернение ΔS наблюдается при использовании электродов с размерами кратера 2×6,5 мм. Исходя из данных таблицы 3.2.1. за оптимальный режим спектрографирования принят следующий: I= 6А, полярность электродов «–», фаза поджига 60º, делитель частоты 2, время экспозиции 40 сек. Почернение аналитических линий замеряли на регистрирующем микрофотометре М – 274 при ширине щели 0,01 мм. Исследовались следующие аналитические линии элементов (нм):
Ba(I) – 3501,1 Ba - 3071,6
Ti(I) – 3385,9 Ti – 3073,0
Таблица 3.2.1. Влияние режимов работы генератора УГЭ-4 на ΔS Ba и Ti; τэ=40с.
| Режим УГЭ - 4 | д/ч 2 | д/ч 3 | ||||
| 2А | 6А | 8А | 2А | 6А | 8А | |
| ± 90º – 90º + 90º – 45º – 60º – 120º – 130º | 0,74 0,81 0,67 — — — — | 0,90 1,09 0,75 0,95 1,11 0,89 0,42 | 0,80 0,84 0,70 — — — — | 0.24 0.28 0,13 — — — — | 0.45 0,50 0,33 — — — — | 0,40 0,44 0,30 — — — — |
3.3 Методика эксперимента
Для проведения исследований использовали 3 образца титаната бария с известным соотношением Ba:Ti.
№1 эталон Ba:Ti = 0,995
№2 эталон Ba:Ti = 0,974
№3 эталон Ba:Ti = 0, 957 К навескам угольного порошка (по 1,0 г) добавляли навески 3-х проб (по 0.1г), взятые на аналитических весах. Далее навески растирали в яшмовой ступке не менее 40 мин каждую. Полученной смесью заполняли угольные электроды, по 8 штук каждой пробы. Затем электроды фотографировали спектрографом на фотопластинку. После фотографирования пластинку проявляли, сушили и находили соответствующие линии по атласам на спектропроекторе.
Однако, тангенс угла наклона этих прямых недостаточен для аналитических исследований. Следовательно, для получения достаточно выраженной зависимости необходимо было провести оптимизацию условий спектрографирования (подбор других спектрографических параметров, изменение спектрографической основы, введение спектрографических добавок (например, NaCl)).
3.4 Подбор оптимальных условий соотношения BaTiO3 и угольного порошка
С целью выявления оптимальных условий спектрографирования были изучены следующие соотношения BaTiO3 и угольного порошка: 1:0, 1:1, 1:2, 1:4, 1:5, 1:8, 1:10. Исследования проводили согласно методике эксперимента с эталоном № 1 (Ba:Ti=0,995) по 3 параллельных измерения каждого соотношения. Из таблицы 3.4.1, 3.4.2, 3.4.3 следует, что наиболее оптимальным условием является соотношение 1:10.Так как у Ba в данном соотношении более четкие линии и наиболее высокая воспроизводимость.
Таблица 3.4.1.
BaTiO3/ угольн. порошок | ΔSBa λ=3071,6 |
(из 3 знач.) | ΔSTi λ=3385,9 |
(из 3 знач.) |
(из 3 знач.) |
| 1:0 | 0,61 0,39 0,44 | 0,48 | 1,20 0,69 0,99 | 0,96 | 0,50 |
| 1:1 | 0,83 0,58 0,70 | 0,70 | 1,41 1,11 1,06 | Газовая хроматография и ее применение в аналитической химии Конструирование биосенсора для регистрации P. aeruginosa АТСС 27853
Актуально:
|
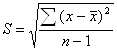 , %
, %