Методичне забезпечення вивчення теми "Метали" в 9 класі
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
Чернігівський державний педагогічний університет імені Т.Г.Шевченка
Дипломна робота
МЕТОДИЧНЕ ЗАБАЗПЕЧЕННЯ ВИВЧЕННЯ ТЕМИ „МЕТАЛИ” В 9 КЛАСІ
МАНЧЕНКО ОЛЕНА СЕРГІЇВНА
ЧЕРНІГІВ – 2007 р.
ЗМІСТ
ВСТУП
РОЗДІЛ 1. Загальні властивості металів. Сплави
1.1 Загальна характеристика металів
1.2 Фізичні властивості металів
1.3 Хімічні властивості металів
1.4 Природні сполуки металів. Добування металів
1.5 Сплави
РОЗДІЛ 2. Форми організації навчання при вивченні теми „Метали” в шкільному курсі хімії
2.1 Традиційна форма організації навчального процесу
2.2 Нетрадиційні форми організації навчальної діяльності
РОЗДІЛ 3. Методичні забезпечення проведення уроків з теми „Метали”
3.1 Тематичне планування теми „Метали”
3.2 Методична розробка нетрадиційного уроку з теми „Загальні відомості про метали”
3.3 Методична розробка традиційного уроку з теми „Ферум: його сполуки, властивості та застосування”
3.4 Методична розробка уроку з використанням лабораторних робіт на тему „Хімічні властивості металів. Електрохімічний ряд напруг металів”
3.5 Розробка узагальнюючого уроку
ВИСНОВКИ
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
ВСТУП
Урок є основною формою організації навчально-виховної роботи вчителя з класом – постійним, однорідним за віком та підготовкою колективом дітей – за державною програмою, твердим розкладом і в шкільному приміщенні. На уроках учні під керівництвом учителя систематично і послідовно відповідно до програми набувають теоретичних знань і практичних вмінь і навичок, а також елементів всебічного розвитку особи. На уроках закладається фундамент світогляду молодого покоління. Основний навчальним матеріал вивчається під час уроку, з ним пов`язані інші форми викладання хімії.
Останнім часом у практику роботи вчителя впроваджуються нетрадиційні форми організації навчально-виховного процесу. Як свідчать результати досліджень та практичний досвід, їх запровадження забезпечує підвищення активності навчально-пізнавальної діяльності учнів, формування самостійності мислення, розвиток творчості.
Метали – основа матеріальної культури людства, основний конструкційний матеріал в машино-, апарато- і приладобудуванні. Всі вони мають загальні, так звані металічні властивості, але серед них виокремлюють близькі між собою типи (родини) металів відповідно до подібності електричних структур їхніх атомів і, отже, їх положення в періодичній системі.
Актуальність. Метали є складовою частиною як живих об`єктів, так і продуктів промисловості. Знання властивостей металів сприяє розширенню загального світогляду школярів та дає знання щодо використання металевих предметів за призначенням, тому підвищення ефективності засвоєння знань учнів з теми „Метали” за рахунок застосування нетрадиційних форм організації навчального процесу є актуальним.
Об`єкт дослідження – навчально-виховний процес в 9 класі при вивченні теми „Метали”.
Предмет дослідження – методичні підходи до вивчення теми.
Мета дослідження: розробити методичне забезпечення вивчення теми „Метали” при вивченні хімії в 9 класі.
У відповідності з поставленою метою ставляться такі завдання:
1) проаналізувати науково-методичну літературу з питання щодо властивостей металів та їх сплавів;
2) проаналізувати різні методичні підходи до вивчення теми;
3) розробити плани-конспекти нетрадиційного, традиційного уроків та уроку з використанням лабораторних робіт.
РОЗДІЛ 1. ЗАГАЛЬНІ ВЛАСТИВОСТІ МЕТАЛІВ. СПЛАВИ
1.1 Загальна характеристика металів
Метали є досить важливими елементами живої природи. Більшість металів входять до складу клітин вищих живих організмів. Питанням вивчення властивостей металів та відкриттям нових займається багато вчених.
Всі періоди періодичної системи починаються з металів. Вздовж періодів поступово послаблюються металічні властивості елементів і посилюються неметалічні.
Атоми металів, як правило, мають у зовнішньому електронному шарі 1, 2 і значно рідше 3 або 4 електрони. Тут з усією очевидністю виявляється вплив зовнішнього електронного шару на властивості елементів. Атоми металів мають низькі значення потенціалів йонізації, тому легше віддають свої електрони, ніж приєднують їх, і перетворюються на позитивно заряджені йони (1-5).
Це означає, що ті елементи, атоми яких мають s2p6-конфігурацію електронів передостаннього енергетичного рівня і містять 1—2 електрони на останньому рівні, виявляють вищу металічну активність. У підгрупах активність таких металів зростає зі збільшенням протонного числа їхніх атомів.
Так, найактивнішими є метали головної підгрупи І групи, особливо Fr. Активними металами є також елементи головної підгрупи II групи, і серед них найактивніший метал — радій.
Атоми металів побічних підгруп мають, як правило, у зовнішньому електронному шарі 1—2 електрони, а в передостанньому — більше восьми. Значення потенціалів йонізації атомів цих металів вищі, а їх активність із збільшенням протонного числа зменшується. Так, найактивнішим металом побічної підгрупи І групи є мідь, найменш активним — золото.
В атомах перехідних металів електрони заповнюють внутрішні енергетичні рівні, тому утримуються ядром сильніше, ніж електрони, розміщені на останньому енергетичному рівні. Цим і пояснюється той факт, що радіуси атомів елементів побічних підгруп менші, ніж передбачалися за аналогією з атомами металів головних підгруп за нормального заповнення електронних шарів. Тому й виникає різка зміна активностей металів головних і побічних підгруп.
1.2 Фізичні властивості металів
До фізичних властивостей металів належать електропровідність, теплопровідність, здатність деформуватися без руйнування. Завдяки пластичності метали можна кувати, вальцювати, витягувати, штампувати. Ця властивість металів має велике практичне значення.
Усі метали за винятком ртуті за звичайних умов — тверді речовини. Найтвердішими є манган та хром, найм'якшим — цезій.
Для металів характерне утворення кристалічних ґраток, у вузлах яких розміщуються переважно йонізовані атоми. Внутрішню будову кристалів визначають за допомогою рентгеноструктурного аналізу.
Кристалічні ґратки металів можуть бути різних типів. Найхарактернішими є три типи: кубічна об'ємноцентрована (лужні метали, хром, ванадій, α-залізо, β-титан, свинець, вольфрам тощо), кубічна гранецентрована (алюміній, мідь, срібло, золото, γ-залізо, нікель, платина, паладій тощо), щільна гексагональна (магній, берилій, цинк, кадмій, а-титан). На рис. 1 подано елементарні комірки основних типів кристалічних ґраток металів.
Багатьом металам, особливо перехідним, властивий поліморфізм. Так, титан, цирконій, скандій, лантан, уран існують у двох алотропних видозмінах, стійких за різних температур, олово, кальцій, хром — у трьох, манган — у чотирьох, плутоній — у шести алотропних видозмінах тощо.
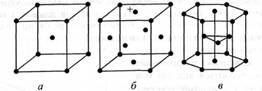
Рис. 1. Основні типи кристалічних ґраток металів (елементарні комірки): а — кубічна об'ємноцентрована; б — кубічна гранецентрована;в — гексагональна
Метали, йони яких мають інертногазову або псевдоінертногазову електронну оболонку, а також йони з конфігурацією зовнішнього шару електронів s2p6d10s2, діамагнітні. Винятком є лужні і лужноземельні метали, які внаслідок сильної делокалізації валентних електронів виявляють парамагнітні властивості.
Атоми перехідних металів, що мають незавершені d- або f-рівні, парамагнітні. Чотири метали (залізо, кобальт, нікель, гадоліній) — феромагнітні, тобто коефіцієнт їх магнітної сприйнятливості >> 1.
Майже всі метали мають високі температури плавлення. За найвищої температури плавляться вольфрам, реній, тантал, за найнижчої— ртуть, галій, цезій.
За густиною всі метали поділяються на важкі та легкі. До легких належать метали, густина яких менша 6 г/см3 (лужні, лужноземельні, магній, берилій, скандій, титан, алюміній, ітрій тощо), до важких,— густина яких перевищує 6 г/см3. Найлегшим металом є літій (0,53 г/см3), найважчим — осмій (22,5 г/cм3).
Механічні властивості металів визначаються будовою їхніх кристалічних ґраток. Висока міцність металів забезпечується створенням умов для досягнення ідеально впорядкованих структур кристалів.
Загальні фізичні і хімічні властивості металів зумовлені подібністю будови їхніх атомів і природи їхніх кристалічних ґраток.
Атоми металів виявляють спорідненість до електрона близьку до нуля або негативну. Саме тому метали є відновниками, оскільки вони легко віддають електрони.
Для пояснення загальних властивостей металів учені А. Зоммерфельд, Е. Фермі, Ф. Блох, Л. Брілюен (6) та інші розробили теорію металічного стану. Згідно з цією теорією (6) у кристалі металу валентні електрони перебувають в іншому стані, ніж у вільних атомах. Під час взаємодії однакових атомів замість енергетично рівноцінних вихідних атомних орбіталей утворюються молекулярні орбіталі, що відповідають різним рівням енергії. Ці молекулярні орбіталі делокалізовані, вони однаковою мірою належать усім атомам, що взаємодіють. У міру збільшення числа таких атомів додавання кожного з них приводить до утворення ще одного енергетичного рівня; число енергетичних рівнів дорівнює числу атомів, що взаємодіють.
Із зростанням числа атомів зростає число дозволених енергетичних станів і зменшуються відстані між сусідніми енергетичними рівнями. У разі великого числа атомів N сусідні рівні відрізняються настільки мало, що утворюється практично суцільна енергетична зона. Електрон, що перебуває на даному рівні, може поводити себе як вільний, якщо найближчий енергетичний рівень не зайнятий електронами. Внаслідок делокалізації орбіталей цей «вільний» електрон може переміщуватися у кристалі під впливом яких завгодно малих енергій. Молекулярні орбіталі, що становлять енергетичну зону, заповнюються електронами в міру зростання енергії, і, згідно з принципом Паулі, на кожній молекулярній орбіталі можуть розміщуватися два електрони. Для прикладу зіставимо значення енергетичних рівнів електронів в ізольованому атомі та в компактному кристалі якого-небудь лужного металу, наприклад натрію. Для ізольованого атома порівняно з кристалом металу відмінність окремих рівнів і підрівнів енергії зовнішніх електронів виявляється різкіше.
Електропровідність металів залежить від кількості електронів, яким відповідають незаповнені енергетичні рівні з низькою енергією. Так, мідь, золото, срібло мають високу електропровідність тому, що для них у кристалі, що містить N атомів, енергетична зона може вмістити 2N електронів, а їх всього N.
Якщо в кристалі всі рівні енергетичної зони заповнені електронами, то через нього струм проходити не може (наприклад, у речовинах з атомними кристалічними ґратками).
Отже, і електро-, і теплопровідність металів зумовлені здатністю валентних електронів вільно перемішуватися по кристалу з верхніх рівнів валентної зони на нижні рівні зони провідності.
З підвищенням температури електропровідність типових металів падає. Це пояснюється тим, що під час нагрівання атоми металу починають інтенсивніше коливатись біля положень їх рівноваги, що утруднює переміщення електронів. Електропровідність напівпровідників під час нагрівання зростає, оскільки інтенсивніше відбувається перехід електронів з валентної зони у юну провідності.
Крім електропровідності і теплопровідності всі інші властивості металів і напівпровідників зумовлені наявністю делокалізованих валентних електронів (12).
1.3 Хімічні властивості металів
Характерною властивістю металів є їхня здатність лише віддавати електрони й утворювати вільні позитивно заряджені йони. Для металів не характерне утворення сполук, в яких вони мають негативний ступінь окиснення. Метали здатні заміщувати Гідроген у кислотах і утворювати солі. Отже, метали можуть бути тільки відновниками.
Найактивніші метали мають малі значення потенціалів йонізації. Атоми активних металів мають великі радіуси і незначну кількість електронів на зовнішньому енергетичному рівні. За величиною потенціала йонізації можна порівняти активність металів у розрідженому газовому середовищі. На повітрі, й особливо у воді, активність металів об'єктивніше характеризується стандартним електродним потенціалом, який визначає, наскільки легко утворюються позитивно заряджені йони з нейтральних атомів за наявності води. Стандартний потенціал — це напруга, що виникає між металом і розчином його солі за активності йонів цього металу, що дорівнює одиниці. Величини стандартних потенціалів відносні. Здатність металів легко утворювати вільні позитивно заряджені йони виявляється в реакціях взаємного витіснення металів або під час взаємодії деяких із них з кислотами-неокисниками (17).
Ряд електрохімічних потенціалів ґрунтується на кількісних значеннях стандартних потенціалів. Всі активні метали, які здатні витісняти Гідроген з кислот-неокисників, стоять у ряду електрохімічних потенціалів до водню. Благородні метали мають позитивні значення стандартних потенціалів і розміщуються за воднем. Зіставивши величини стандартних потенціалів, можна зробити висновок, який з металів витіснятиме інший метал із розчину його солі.
Положення металу в ряду електрохімічних потенціалів характеризує його здатність до окисно-відновних перетворень за стандартних умов. Чим ближче метал розміщений до початку ряду електрохімічних потенціалів, тим сильніші відновні властивості його атомів і тим слабкіші окиснювальні властивості його йонів у водному розчині.
1.4 Природні сполуки металів. Добування металів
Більшість металів у земній корі перебуває у вигляді сполук з іншими елементами. У самородному стані трапляються тільки благородні метали, які характеризуються високими потенціалами йонізації (золото, платина, платинові метали, частково срібло, мідь і ртуть).
Мінерали або їх суміші, придатні для промислового добування металів, називаються рудами. Рудами є суміші благородного металу або його сполуки з різними силікатами. Пустою породою називаються домішки, що супроводжують метал або його сполуку в руді.
Найчастіше в земній корі трапляються малорозчинні у воді та стійкі проти окиснення мінерали.
Досить стійкими і малорозчинними є сульфіди багатьох металів. Іноді сульфіди трапляються разом з арсенідами (руди Co та Ni). Сульфідні руди, що містять цинк, свинець, срібло, мідь, бісмут з домішками рідкісних металів (германій, реній, індій), називаються поліметалічнимирудами.
Сульфідів активних металів у земній корі не виявлено, оскільки вони нестійкі (12).
Лужноземельні метали і рідкісноземельні елементи в природі трапляються у вигляді не розчинних у воді карбонатів, фторидів, фосфатів. Кальцій, стронцій і барій входять до складу сульфатних мінералів, лужні метали — до складу подвійних силікатів. Для натрію і калію поширеними є хлоридні мінерали, які утворилися в результаті кристалізації розчинів під час висихання озер і морів.
Добуванням металів з руд займається галузь промисловості — металургія.
Для збагачення руд застосовують методи магнітної та гравітаційної сепарації, пінної флотації. Магнітну сепарацію можна застосовувати лише тоді, коли потрібний компонент руди виявляє магнітні властивості, і руди, притягуючись до магніта, переносяться ним у збірник руди. Методом гравітаційної сепарації здійснюється відокремлення мінералу, який потрібно вилучити з руди, від домішок за допомогою важких розчинів, що мають проміжну густину (між густиною мінералу і домішок). Часточки легкого компонента спливають на поверхню.
Флотація ґрунтується на різній змочуваності водою пустої породи і мінералу. Часточки компонента, який змочується водою, поглинаються, а часточки, що не змочуються, спливають на поверхню.
Для добування металу з його сполуки, що міститься у руді, потрібно його відновити.
Найважливішим методом добування металів із руд є відновлення їхніх оксидів вуглецем або оксидом карбону (ІІ).
Відновлення металів із руд вуглецем і оксидом карбону (II) відбувається за високих температур, тому цей метод добування металів належить до пірометалургійних.
Для металів, які не відновлюються вуглецем і оксидом карбону(ІІ) (активні метали), застосовують сильніші відновники: водень, магній, алюміній, силіцій. Метод відновлення оксиду одного металу іншим металом називається металотермією (якщо відновником є алюміній — алюмотермією). Метало-термічним методом виплавляють титан, цирконій, рідкісноземельні метали, уран, хром тощо.
Для добування металів застосовують також гідрометалургійний метод, тобто електроліз водних розчинів солей та витіснення металів з їхніх розчинів іншими металами. Гідрометалургійним методом добувають золото (витіснення його з ціанідних розчинів за допомогою цинку) (17).
Електропірометалургійним методом добувають лужні, лужноземельні метали, алюміній, титан, торій, ніобій, тантал. Суть цього методу полягає в електролізі розплавлених солей. За цим методом добувають дуже активні метали, які не можна добути, використовуючи звичайні відновники.
1.5 Сплави
У рідкому стані більшість металів розчиняється один в одному, утворюючи рідкий сплав. Сплавами називаються гомогенні суміші металів у розплавленому і затверділому станах. Затверділі сплави мають різну природу: вони можуть виявляти характер твердих розчинів, хімічних сполук, бути гетерогенними.
Щоб визначити природу сплаву, поверхню досліджують мікроскопічним методом, а також піддають його рентгеноструктурному аналізу. Проте найчастіше сплави досліджують, проводячи фізико-хімічний аналіз (17).
Про взаємодію між металами можна судити на підставі вимірювання питомої електропровідності систем (електропровідність окремих металів вища за електропровідність утворених ними інтерметалідів). Внаслідок взаємодії металів змінюється їхня твердість, магнітна сприйнятливість. Склад утвореного металіду можна визначити, не виділяючи його в чистому вигляді, якщо вивчати зміну однієї з названих властивостей.
Нині фізико-хімічний аналіз є основним методом вивчення природи різних сплавів. Розділ фізико-хімічного аналізу, що досліджує перетворення в системі за зміною температури її плавлення або тверднення залежно від складу, називається термічним аналізом. Діаграми температура плавлення — склад називаються діаграмами стану, або діаграмами плавлення системи. Термічний аналіз до вивчення сплавів вперше застосував у 1868 р. Д. К. Чернов, а в 1900 р. видатний російський вчений М. С. Курнаков розробив метод встановлення складу сполук у сплавах за допомогою термічного аналізу.
Для того щоб побудувати діаграму стану, досліджують експериментально криві охолодження. Розплавлений чистий метал поступово охолоджують, вимірюючи зміну температури сплаву з часом. На діаграмі температура — час дістають горизонтальну лінію, що відповідає температурі плавлення металу (затримка в охолодженні металу зумовлена виділенням прихованої теплоти кристалізації). Якщо до металу А додати метал В, то в разі поступового охолодження рідкого сплаву кристали металу А осідатимуть за нижчої температури, ніж коли б це був чистий метал. Якщо ж до чистого металу В додати метал А, спостерігатиметься аналогічна картина. Щоб побудувати діаграму стану для двохкомпонентної системи, виготовляють суміші двох чистих металів із різним їх кількісним складом, розплавляють їх і визначають температури початку кристалізації як зупинки на діаграмах температура — час (рис. 2).
Діаграми плавлення мають різну форму залежно від характеру взаємодії компонентів суміші між собою.
Якщо два метали між собою не утворюють сполуку, а в твердому стані не утворюють розчин, то діаграма стану для такої системи має так звану евтектичну точку, яка вказує на існування сплаву з найнижчою температурою плавлення. Сплав, який має таку низьку температуру плавлення, у твердому стані є сумішшю дрібних кристалів і називається евтектикою.
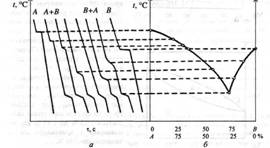
Рис. 2. Криві охолодження (а) та діаграма стану двохкомпонентної системи (б)
Термічний аналіз дає змогу виявити велику кількість сполук одних металів з іншими (інтерметалідних сполук). Такі сполуки утворюють лужні, лужноземельні метали з металами, що мають слабкі металічні властивості. Склад інтерметалідних сполук виражається формулами, в яких валентності металів не збігаються з валентностями цих металів у сполуках з неметалами. Наприклад, натрій з оловом утворює такі сполуки: NaSn4, NaSn6, NaSn3, NaSn2, NaSn, Na4Sn2, Na2Sn, Na4Sn.
Властивості сплавів відрізняються від властивостей компонентів сплаву. Температура плавлення сплаву, як правило, нижча за температуру плавлення найбільш легкоплавкого його компонента, а твердість вища, ніж твердість складових частин сплаву. Особливо сильно зростає твердість сплаву, якщо під час сплавляння утворюються хімічні сполуки металів. Високою твердістю характеризуються сплави, що містять тверді розчини. Низькі температури плавлення, висока твердість надають сплавам більшої цінності для сучасної техніки, ніж цінність металів, з яких їх виготовляють (17).
РОЗДІЛ 2. ФОРМИ ОРГАНІЗАЦІЇ НАВЧАННЯ ПРИ ВИВЧЕННІ ТЕМИ „МЕТАЛИ” В ШКІЛЬНОМУ КУРСІ ХІМІЇ
2.1 Традиційна форма організації навчального процесу
В системі форм навчання і виховання учнів головна роль належить уроку. Це пояснюється тим, що тільки на уроці реалізується навчальна програма.
В методиці навчання хімії за основу розподілу уроків на типи і види в різні часи обиралися різні ознаки. Так, у перші роки викладання хімії в радянській школі, коли на перший план висувався формально-логічний, або «дослідницький», метод викладання, основною формою навчання був так званий лабораторний урок. У розробці методики проведення таких уроків велика заслуга належить В. Н. Верховському (23).
Коли на перший план стали висувати не методи, а характер навчально-виховного процесу, типи уроків почали розрізняти за дидактичними цілями. Так, С. Г. Шаповаленко, П. О. Глоріозов, Д. М. Кирюшкін (22) розподіляли уроки хімії на п'ять типів: вивчення нових знань, їх закріплення, узагальнення, облік і особливий тип уроку — змішаний, або комбінований. С. В. Дьякович (23) за дидактичною метою розрізняє такі типи уроків: а) засвоєння нових знань і умінь (вивчення нового матеріалу); б) удосконалення і застосування теоретичних знань і умінь; в) узагальнення й систематизація знань; г) контрольно-облікові; д) змішані (комбіновані).
За останні роки на розробку проблеми уроку хімії великий вплив справило вчення про логіку навчального процесу, розроблене дидактами. У світлі цього вчення кожний урок хімії розглядається як завершена частина навчання, в якій виявляються властиві йому закономірності. На кожному уроці розв'язується ряд взаємозв'язаних дидактичних завдань, одне з яких є провідним, наприклад засвоєння учнями нового матеріалу, а інші — повторення знань, закріплення і узагальнення вивченого, перевірка досягнень учнів — підпорядковуються провідному завданню. Відповідно до цього будь-який урок можна розглядати як комбінований. Тому багато методистів беруть під сумнів необхідність відокремлення комбінованих уроків як особливого їх типу. Р. Г. Іванова (11), наприклад, враховуючи те, що для вчителя важливіше знати, чому підпорядковувати весь процес навчання на уроці, а не сам факт «комбінування» етанів уроку, його навчальних завдань, класифікує уроки хімії на три типи відповідно до головної дидактичної мети, а саме:
1) уроки вивчення учнями нового матеріалу і набування нових умінь;
2) уроки вдосконалення знань і умінь учнів;
3) уроки перевірки знань і умінь учнів.
Така класифікація найбільш поширена сьогодні в методиці навчання хімії, проте і її слід розглядати як відносну. Адже навчальний характер уроку передбачає, щоб поряд з викладанням учням нових знань забезпечувалися закріплення їх і зворотний зв'язок, який сигналізував би про засвоєння знань учнями. На уроках, присвячених повторенню вивчених питань, можуть передаватися учня і деякі новізнання, здійснюватися перевірка засвоєного тощо. Реальні уроки і хімії настільки різноманітні, що неможливо врахувати всі їх варіанти, які створюються на практиці за допомогою комплексного використання прийомів, форм і методів навчання для розв'язання головних і супровідних завдань, котрі до того ж розв'язуються на різних рівнях залежно від етапу навчання.
Уроки кожного типу поділяються на види, які відрізняються між собою загальними методами розв'язання головної дидактичної мети: уроки з використанням пояснювально-ілюстративного, частково-пошукового і дослідницького методів (за Р. Г. Івановою) (11). Уроки кожного виду ще мають різновиди, залежно від окремих конкретних методів, які переважно застосовуються для досягнення головної мети. Відповідно розрізняють урок-бесіду, урок-лекцію, урок-екскурсію, урок-практичне заняття, урок-контрольну роботу, кіноурок тощо.
Такий підхід до класифікації уроків робить її вкрай відносною, позбавляє чіткості. Адже при одному і тому самому провідному методі вчитель використовує звичайно ще багато допоміжних методів і прийомів, які відіграють під час уроку не менш важливу роль. Інколи буває, що різноманітність застосованих на уроці прийомів взагалі не дає можливості точно визначити його вид. Отже, немає необхідності в тому, щоб формально дотримуватися типізації уроків, штучно визначати їх вид.
2.2 Нетрадиційні форми організації навчальної діяльності
Крім основної форми проведення уроку існують альтернативні форми проведення уроків, тобто нетрадиційні форми уроків. Ці форми уроків користуються значною популярністю в старшій школі. Їх використання сприяє залученню школярів до самостійної та творчої роботи, розвитку аналітичного мислення.
Урок-лекція
Лекція — одна із форм організації навчання в загальноосвітньому навчальному закладі. Її основою є системне усне викладення вчителем навчального матеріалу протягом одного уроку (чи пари уроків), головний зміст якого становлять аналіз та узагальнення фактів, а провідними прийомами є пояснення й міркування. Залежно від теми лекції в ній можуть превалювати характеристика, опис, розповідь про певні факти, процеси, явища. Структура традиційної лекції така: організація діяльності вчителя й учнів; формулювання теми, постановка мети і завдань; актуалізація опорних знань учнів; викладення змісту дидактичного матеріалу вчителем, забезпечення умов сприйняття та засвоєння Його учнями; узагальнення та систематизація знань учнів, здобутих у процесі читання лекції.
У процесі підготовки, до лекції вчителеві необхідно: визначити оптимальний обсяг нової інформації; забезпечити відповідність інформації теоретичним положенням тієї науки, до якої належить навчальний предмет; акцентувати увагу учнів на основному, істотному; забезпечити повноту та глибину реалізації змісту навчального матеріалу. Важливо також вибрати та раціонально використати методи і засоби викладу змісту лекції, визначити метод-домінанту викладання навчального матеріалу (репродуктивний, проблемний, творчий). Специфічним, як стверджує І.М.Чередов (3), у лекції відносно до уроку є етап визначення домашнього завдання. Тут важливо уникати перевантаження учнів. З цією метою доцільно давати диференційовані завдання, план семінарського заняття з теми лекції, розраховуючи на те, то учні заздалегідь почнуть готуватися до обговорення конкретних питань за змістом лекції (20).
Залежно віл дидактичної мети та місця в логічній структурі навчального матеріалу розрізняють такі типи лекцій: вступна, оглядова, узагальнююча, лекція-інструктаж.
Специфіка вступної лекції полягає в тому, що її головною метою є розкриття провідних ідей і аспектів курсу навчального предмета, перспективи навчальної роботи з учнями щодо оволодіння змістом курсу предмета. При цьому важливо використовувати внутрішньокурсові та міжкурсові зв'язки. їх реалізація забезпечує цілісне сприйняття та уявлення про предмети, які вивчаються, їхню практичну значущість. Для вступної лекції найтиповішими прийомами викладання навчального матеріалу є порівняння, співставлення, спирання на знання учнів, здобуті у практичній діяльності та спілкуванні, доведення, висновки, оціночні судження.
Оглядова лекція проводиться, як правило, з метою висвітлення широкого кола питань з того чи іншого курсу навчального предмета, ознайомлення з новою інформацією з цих питань, розширення світогляду учнів. Важливим моментом оглядової лекції є відбір і структурування навчального матеріалу, що забезпечує підготовку учнів до логічного сприйняття систематизованої інформації та засвоєння системних знань. Превалюючими прийомами оглядової лекції є розповідь, опис та аналіз фактів, явищ, процесів. Засобами реалізації змісту оглядової лекції є раціональне поєднання слова вчителя та наочності (таблиць, кодокарт, кодофільмів, різних видів ТЗН, зокрема комп'ютера та iн.)
Узагальнююча лекція зазвичай проводиться після вивчення повного курсу навчального предмета або великого його розділу метою систематизації та поглиблення знань учнів. Вона є підсумком системи проведених раніше уроків і включає провідні аспекти курсу даного навчального предмета. У процесі узагальнюючої лекції доцільним є використання узагальнюючих таблиць, схем, ТЗН тощо.
Лекція-інструктаж проводиться з метою підготовки учнів до семінару, лабораторної роботи, практичного заняття. Розкриваючи теоретичний і прикладний аспекти теми лекції, вчитель акцентує увагу на можливих та доцільних шляхах використання теоретичних знань, навичок і вмінь у процесі самостійної роботи; дає розгорнуте трактування того кола питань, які передбачено розглянути на наступному занятті. На лекції-інструктажі можуть бути поставлені завдання репродуктивного, реконструктивного, варіативно-тренувального, пошукового та творчого характеру; зосереджується увага учнів на джерелах додаткової інформації.
Таким чином, з метою підвищення якості лекції вчителеві необхідно чітко визначити місце теми лекції в логічній структурі курсу навчального предмета, оптимальний обсяг навчального матеріалу, форми, методи та засоби ефективної його реалізації. Залежно від форми організації і керування навчально-пізнавальною діяльністю учнів лекція може бути монологічною, діалогічною, полемічною.
Характерними ознаками монологічної лекції є превалююче викладання її змісту самим учителем, який розкриває ті чи інші положення у вигляді готових висновків. У ньому випадку учні сприймають на слух інформацію, фіксують основні положення, запам'ятовують. Монологічна лекція має свої переваги та недоліки. Переваги полягають у тому, що вчитель може чітко визначити обсяг змісту лекції та забезпечити її реалізацію, регламентувати діяльність вчителя і діяльність учнів, поділити матеріал на блоки й фрагменти, варіювати ними залежно від сприйняття учнями інформації.
Діалогічна лекція розрахована на пасивний ступінь участі учнів у розкритті її змісту при керівній та спрямовуючій ролі вчителя. Лекція, яка проводиться в діалогічній формі, досягає успіху тоді, коли вчителем добре продумані та сформульовані запитання для діалогу з учнями, передбачені можливі варіанти відповідей на них, визначені серед них найбільш суттєві (2).
Полемічна лекція передбачає викладання змісту матеріалу у вигляді постановки дискусійних проблем, ідей, положень, що вимагають розв'язання в ході дискусії. При цьому не виключені різні думки з того чи іншого питання. Роль учителя у проведенні полемічної лекції дуже складна. Йому необхідно бути ерудитом, володіти мистецтвом полеміки, орієнтуватися в різних поглядах та спрямовувати учнів на правильні висновки. Крім того, він має: бути демократичним, справедливим, винахідливим, в міру гнучким. Полеміка — один зі способів ефективного емоційного виливу на учня збудження його інтересу, щирості, бажання шукати істину (3).
Незалежно від типу лекції у процесі її спостереження та аналізу слід звернути увагу на такі параметри:
- підготовка вчителя до лекції (доцільний вибір теми лекції);
- постановка триєдиної мети та завдань лекції; розробка систем питань (плану), що розкривають зміст лекції; знання основної та допоміжної літератури з теми лекції; засобів її реалізації, визначення провідних ідей, вибір оптимальної структури лекції логічність викладання матеріалу;
- прийоми викладання вчителем навчального матеріалу (пояснення, міркування, використання наочності, у тому числі ТЗН, комп'ютерної техніки, додаткового дидактичного матеріалу);
- прийоми організації навчально-пізнавальної діяльності учнів у процесі читання лекції складання розгорнутого або тезисного плану;
- конспектування лекції; фіксація фактів, які необхідні для наступного проведення практичного заняття чи лабораторної роботи, розв'язання задач тощо; вибір прийомів запису матеріалу лекції);
- способи активізації навчально-пізнавальної діяльності учнів (постановка запитань і завдань для аналізу, зіставлення і порівняння різних фактів, явищ, самостійних висновків та пропозицій);
- привертання уваги учнів до змісту лекції за допомогою відомих прийомів спілкування під час її читання: «Це особливо важливо!..», «Вдумайтесь...», «Зверніть увагу...» тощо; за допомогою таких висловів: «Зробимо висновки», Отже ми бачимо...; риторичних запитань, на які її пізніше дасть відповідь сам учитель: «Чим пояснити цей факт?, «Як пов'язані між собою ці події?», пауз, які дають змогу учням вдуматися у викладене;
- тип лекції залежно від дидактичної мети і її місця в логічній структурі навчального матеріалу і (вступна, оглядова, узагальнююча, і лекція-інструктаж); залежно від форми організації і керування навчально-пізнавальною діяльністю учнів (монологічна, діалогічна, полемічна);
- ефективність лекції: стан дисципліни учнів; інтерес до інформації, викладеної вчителем; якість виконання навчальних завдань; вміння учнів робити висновки, вносити пропозиції; міцність, повнота та глибина знань учнів з висвітленої теми.
Семінарське заняття є формою навчання, що дає змогу ефективно і організувати самостійну роботу учнів. Семінарські заняття найчастіше проводяться у старших класах. При цьому учням надається можливість активно оперувати знаннями, здобутими на уроках, а також у процесі самостійної роботи з рекомендованою літературою. На семінарському занятті допустимі дискусії, заперечення, обговорення, аргументація тощо, що дає змогу учням більш осмислено і міцно засвоювати тему. Семінар — це живий творчий процес, який не може бути запрограмований в усіх деталях (20).
Основними завданнями семінарського заняття є: закріплення, розширення та поглиблення знань учнів, здобутих раніше на уроках; формування і розвиток навичок самостійної роботи учнів; реалізація диференційованого підходу до навчання з урахуванням індивідуальних особливостей учнів; створення умов для формування й розвитку їхніх пошуково творчих знань та навичок.
За характером семінарські заняття поділяються на