Рентгеноструктурний аналіз молибдену
Фізичні властивості молібдену
Молібден (лат. Molybdaenum), Mo, хімічний елемент VI групи періодичної системи Менделєєва; атомний номер 42, атомна маса 95,94; світло-сірий тугоплавкий метал. У природі елемент представлений сімома стабільними ізотопами з масовими числами 92, 94-98 і 100, з яких найбільш поширений 98Мо (23,75%). Аж до 18 століття основний мінерал молібден молібденовий блиск (молібденіт) не відрізняли від графіту і свинцевого блиску, оскільки вони дуже схожі на вигляд. Ці мінерали носили загальну назву "молібден" (від греч. molybdos - свинець).
Елемент молібден відкрив в 1778 році шведський хімік К. Шееле, що виділив при обробці молібденіту азотною кислотою молібденову кислоту. Шведський хімік П. Гьельм в 1782 році вперше одержав металевий молібден відновленням МоО3вуглецем.
Розповсюдження молібдену в природі. Молібден - типовий рідкісний елемент, його вміст в земній корі 1,1·10-4% (по масі). Загальне число мінералів молібдена 15, велика частина їх (різні молібдати) утворюється в біосфері. У магматичних процесах молібден пов'язаний переважно з кислою магмою, з гранітоїдамі. У мантії молібдену мало, в ультраосновных породах лише 2·10-5%. Накопичення молібдену пов'язане з глибинними гарячими водами, з яких він осідає у формі молібденіту MoS2 (головний промисловий мінерал молібдену), утворюючи гидротермальниє родовища.
Геохімія молібдену в біосфері тісно пов'язана з живою речовиною і продуктами його розпаду; середній вміст молібдену в організмах 1·10-5%. На земній поверхні, особливо в лужних умовах, Mo (IV) легко окислюється до молібдатов, багато з яких порівняльне розчинні. У ландшафтах сухого клімату молібден легко мігрує, накопичуючись при випаровуванні в соляних озерах (до 1·10-3%) і солончаках. У вологому кліматі, в кислих ґрунтах молібден часто малорухливий; тут потрібні добрива, що містять молібден (наприклад, для бобів).
У річкових водах молібдену мало (10-7 - 10-8%). Поступаючи із стоком в океан, молібден частково накопичується в морській воді (в результаті її випаровування молібдену тут 1·10-6%), частково осідає, концентруючись в глинистому мулі, багатому органічною речовиною і H2S. Крім молібденових руд, джерелом молібдену служать також деякі мідні і мідно-свинцево-цинкові руди.
Фізичні властивості молібдену. Молібден кристалізується в кубічну об'емоцентровану гратку з періодом а = 3,14Å. Атомний радіус 1,4 Å, іонні радіуси Мо4+ 0,68 Å, Мо6+ 0,62 Å. Густина 10,2 г/см3 (20 °С); tпл 2620 °С; tкип близька до 4800 °С. Питома теплоємність при 20-100°С 0,272 кдж/(кг·К), тобто 0,065 кал/(г·град). Теплопровідність при 20°С 146,65 вт/(м·К), тобто 0,35 кал/(см·сек·град). Термічний коефіцієнт лінійного розширення (5,8-6,2)·10-6 при 25-700 °С. Питомий електричний опір 5,2·10-8 ом·м, тобто 5,2·10-6ом·см; робота виходу електронів 4,37 ев. Молібден парамагнетик; атомна магнітна сприйнятливість -90·10-6 (20 °С).
Механічні властивості молібдену залежать від чистоти металу і попередньої механічної і термічної його обробки. Так, твердість по Брінеллю 1500-1600 Мн/м2, тобто 150-160 кгс/мм2 (для спеченого штабіка), 2000-2300 Мн/м2 (для кованого прутка) і 1400-1850 Мн/м2 (для відпаленого дроту); межа міцності для відпаленого дроту при розтягуванні 800-1200 Мн/м2. Модуль пружності молібдену 285-300 Гн/м2. Мо більш пластичний, ніж W. Рекристаллізуючий відпал не приводить до крихкості металу.
Отримання молібдену. Основною сировиною для виробництва молібдену, його сплавів і з'єднань служать стандартні молібденітові концентрати, що містять 47-50% Мо, 28-32% S, 1-9% SiO2 і домішки інших елементів. Концентрат піддають окислювальному випаленню при 570-600 °С в багатоподовых печах або печах киплячого шару. Продукт випалювання - недогарок містить МоО3, з домішками. Чисту МоО3, необхідну для виробництва металевого молібдену, одержують з недогарка двома шляхами: 1) сублімацією при 950-1100 °С; 2) хімічним методом, який полягає в наступному: недогарок вилуджують аміачною водою, переводячи молібден в розчин; з розчину молібдата амонія (після очищення його від домішок Cu, Fe) виділяють полімолібдати амонія (головним чином парамолібдат 3(NH4)2O·7МоО3·nН2О) методом нейтралізації або випаровування з подальшою кристалізацією; прожаренням парамолібдата при 450-500 °С одержують чистий МоО3, що містить не більш 0,05% домішок.
Металевий молібден одержують (спочатку у вигляді порошку) відновленням МоО3 в струмі сухого водню. Процес ведуть в трубчастих печах в дві стадії: перша - при 550-700 °С, друга - при 900-1000 °С. Молібденовий порошок перетворюють на компактний метал методом порошкової металургії або методом плавки. У першому випадку одержують порівняно невеликі заготовки (в перерізі 2-9 см2 при довжині 450-600 мм). Порошок молібдену пресують в сталевих прес-формах під тиском 200-300 Мн/м2 (2000-3000 кгс/см2). Після попереднього спікання (при 1000-1200 °С) в атмосфері водню заготовки (штабіки) піддають високотемпературному спіканню при 2200-2400 °С. Спечений штабік обробляють тиском (кування, протяжка, прокатка). Крупніші спечені заготовки (100-200 кг) одержують при гідростатичному пресуванні в еластичних оболонках. Заготовки в 500-2000 кг виробляють дуговою плавкою в печах з охолоджуваним мідним тіглем і електродом, що витрачається, яким служить пакет спечених штабіков. Крім того, використовують електронопроменеву плавку молібдену. Для виробництва ферромолібдена (сплав; 55-70% Мо, інше Fe), призначеного для введення присадок молібдену в сталь, застосовують відновлення обпаленого молібденітового концентрату (недогарка) феросиліцієм у присутності залізної руди і сталевої стружки.
Застосування молібдену. 70-80% молібдену, що видобувається, йде на виробництво легованих сталей. Решта застосовується у формі чистого металу і сплавів на його основі, сплавів з кольоровими і рідкісними металами, а також у вигляді хімічних з'єднань. Металевий молібден - найважливіший конструкційний матеріал у виробництві електроосвітлювальних ламп і електровакуумних приладів (радіолампи, генераторні лампи, рентгенівські трубки ); з молібдену виготовляють аноди, сітки, катоди, утримувачі нитки розжарення в електролампах. Молібденовий дріт і стрічка широко використовують в якості нагрівачів для високотемпературних печей.
Після освоєння виробництва великих заготовок. Молібден стали застосовувати (у чистому вигляді або з легуючими добавками інших металів) в тих випадках, коли необхідне збереження міцності при високих температурах, наприклад, для виготовлення деталей ракет і інших літальних апаратів. Для оберігання молібдену від окислення при високих температурах використовують покриття деталей силіцидом молібдену, жаростійкими емалями і іншими способами захисту. Молібден застосовують як конструкційний матеріал в енергетичних ядерних реакторах, оскільки він має порівняно малий перетин захоплення теплових нейтронів (2,6 барн). Важливу роль молібден виконує у складі жароміцних і кислототривких сплавів, де він поєднується головним чином з Ni, Co і Cr.
У техніці використовуються деякі з'єднання молібдену. Так, MoS2 - змащувальний матеріал для частин механізмів, що труться; дісиліцид молібдену застосовують при виготовленні нагрівачів для високотемпературних печей; Na2MoO4 - у виробництві фарб і лаків; оксиди молібдену - каталізатори в хімічній і нафтовій промисловості.
Структурні методи дослідження речовини.
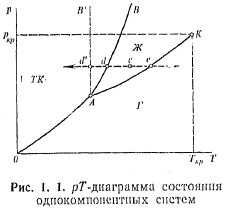
Рідкий стан речовини є проміжним між твердим і газоподібним (мал. 1.1). Область існування рідини обмежена з боку низьких температур переходом в твердий стан (точки cdd') аз боку високих — переходом в газоподібний стан (точки с, е).ЛініяАК, щорозділяє рідку і газоподібну фази, закінчується критичною точкою, відповідній температурі Ткрі тиску Pкр, вище за яких неможливе існування рідини в рівновазі з парою. Лінія рівноваги рідина — тверда фаза критичної точки не має. У металів температура плавлення підвищується із збільшенням тиску (крива АВ); у льоду, кремнію, германію — знижується (криваАВ'). ТочкаА надіаграмі стану відповідає температурі і тиску, при яких в закритій посудині знаходяться в рівновазі тверда, рідка і газоподібна фази. Рідині поєднують деякі властивості як твердих тіл, так і газів. Тверді тіла бувають кристалічні і аморфні. По типах зв'язку кристали діляться на атомні, іонні, металеві і молекулярні. Вони мають ближній і дальній порядок. Ближній порядок означає правильне розташування біля фіксованого атома, іона або молекули певного числа найближчих сусідів. Дальнім порядком називається розташування частинок в певній послідовності з утворенням єдиної тривимірної гратки. За наявності дальнього порядку відстань до будь-якого атома кристала обчислюється через параметри елементарної комірки по формулі
Ri =mia+ni+pic(1)
де minipi координати атомів гратки.
Кристалічні тіла являються анізотропними, їх механічні, теплові, електричні і оптичні властивості у різних напрямах не однакові. Одна і та ж кристалічна речовина може знаходитися в декількох модифікаціях, які мають неоднакові структури. Так, вуглець існує у вигляді графіту, алмазу і карбіну, двоокис кремнію — у вигляді кварцу, тридиміта і крістабаліта;
сірка — у вигляді ромбічної і моноклінної модифікацій. Атоми, іони або молекули кристалів здійснюють узгоджені (колективні) коливання біля фіксованих положень рівноваги. У кристалах можливі пульсуючі рухи елементарних комірок, пульсації молекул, при яких вони періодично витягуються і стискаються у різних напрямах. Проведені І. Б. Берсукером дослідження показали, що пульсуючі рухи породжують поляризацію, роблять сильний вплив на оптичні, магнітні і інші властивості речовини. У газоподібному стані речовини атоми і молекули взаємодіють один з одним за допомогою ван-дер-ваальсових сил тяжіння на великих в порівнянні з розмірами частинок відстанях і квантово-механічних сил відштовхування на малих відстанях. Сили тяжіння в газах дуже слабкі, щоб надовго утримати молекули разом, тому розташування молекул в газі хаотичне. Молекули газу знаходяться в безперестанному русі, який відбувається не узгоджено (індивідуальних) у вигляді переміщень і зіткнень в кінці вільного пробігу. Кінетична енергія молекули газу значно більше потенційної. Якщо молекули багатоатомні, то при своєму поступальному русі вони можуть обертатися як ціле, здійснюють коливання, що становлять їх атоми.
Рідина—система динамічна. Атоми або молекули, зберігаючи ближній порядок у взаємному розташуванні, беруть участь в тепловому русі, який складніший, ніж в кристалі. Атоми і молекули рідини здійснюють коливання, як в кристалах, але положення рівноваги, щодо яких відбуваються ці коливання, не залишаються фіксованими. Зробивши деяке число коливань близько одного положення рівноваги, молекули переміщаються в сусіднє положення, обумовлюючи явище дифузії.
Переміщення молекул з одного рівноважного положення в інше може відбуватися: а) стрибком на відстань R1 близьке до середнього міжмолекулярного, і б) плавно разом з їх найближчим оточенням. У молекулах, що містять одинарні і подвійні зв'язки, можливі повороти атомів або груп атомів навколо цих зв'язків, що приводить до утворення ізомерів даного хімічного з'єднання. Згідне Я. І. Френкелю, тривалість перебування молекули в тимчасовому положенні рівноваги — час осілого життя — визначається по формулі:
![]() , (2)
, (2)
де τ0 — період коливань молекули біля положення рівноваги; U— висота потенційного бар'єру, який відділяє один від одного два сусідні положення рівноваги; k— постійна Больцмана; T— термодинамічна температура. Числове значення τ залежить від будови і в'язкості рідини. По теоретичних розрахунках І. 3. Фішера, для аргону поблизу потрійної точки τ = 2,3 · 10-13 с; для води при кімнатній температурі τ = 10-10 с, τ0= 1,4 · 10-12 с. Отже, кожна молекула води здійснює близько 100 коливань щодо одного і того ж положення рівноваги, перш ніж змінити місце.
По образному виразу Я.І. Френкеля, молекули в рідині ведуть в основному осілий спосіб життя, що є характерною межею рідкого стану, що зближує його з твердим тілом, з тією різницею, що в твердих тілах час осілого життя набагато більше, ніж в рідких. Із зростанням температури час осілого життя молекул в тимчасовому положенні рівноваги зменшується, відмінність між τ і τ0 поступово зникає. При цьому роль поступального руху молекул посилюється, а коливального — ослабляється, структура рідини все більш наближається до газової.
По теорії Я. І. Френкеля, у разі простих рідин через час осілого життя визначаються:
а) середня швидкість переміщення молекул рідини
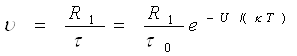 (3)
(3)
б) самодифузія, що характеризує швидкість взаємного перемішування молекул,
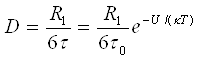 (3`)
(3`)
в) в'язкість, що характеризує передачу імпульсу молекулами рідини,
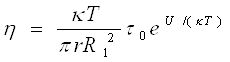 (4)
(4)
Приведені формули відображають активаційний (прижковий) характер руху молекул. Досвід показує, що в рідинах молекули можуть переміщатися безперервно по траєкторіях дрейфу, без раптових стрибків. Такий тип руху домінує в зріджених інертних газах і в розплавлених металах. У асоційованих рідинах (наприклад, воді) більш вірогідний прижковий характер переміщення молекул.
Поступальне переміщення молекул рідини вкладає певний внесок в теплопровідність. Проте основним чинником, що визначає теплопровідність рідини, є процес розповсюдження пружних хвиль, породжених тепловими коливаннями молекул. Ці хвилі імітуються фононами (по аналогії з фотонами — квантами електромагнітних хвиль). Виходячи з кінетичної теорії теплопровідність для рідин можна виразити формулою:
![]() (5)
(5)
де с — теплоємність рідини, v— швидкість розповсюдження фононів, λ — довжина їх вільного пробігу. Ангармонізм коливального руху, безперервне переміщення молекул у всьому об'ємі рідини обмежує довжину вільного пробігу фононів, а отже, і теплопровідність.
У рідинах на відміну від газів домінують ті ж міжмолекулярні сили тяжіння, які обумовлюють той або інший тип зв'язку в кристалі. Так, наприклад, між атомами зріджених інертних газів діють ван-дер-ваальсовиє сили. Ті ж сили викликають взаємне тяжіння молекул неполярних рідин. Молекули води, кислот жирного ряду і спиртів взаємодіють один з одним за допомогою водневих зв'язків, виникнення яких пов'язане з наявністю в їх складі гідроксильних груп ОН. У розплавах солей діють електростатичні сили тяжіння, в металах — сили металевого зв'язку.
У рідкому германії, кремнії і інших напівпровідникових речовинах разом з металевим зв'язком частково зберігається ковалентний зв'язок. Кожна група рідин володіє специфічним ближнім порядком, успадковуваним від твердого тіла. Невелика відмінність густини рідин і кристалів, їх питомих теплоємностей і коефіцієнтів об'ємного розширення, з одного боку, указує на істотну відмінність теплот плавлення і паротворення, а з іншою — на те, що рідини по характеру взаємного розташування частинок, їх динаміці і взаємодії ближче до твердого, а не газового стану речовини. Я. І. Френкель писав, що зближення рідин з реальними газами допустиме лише у разі, коли рідина знаходиться при високих температурах, близьких до критичної, і володіє малою густиною. З другого боку, безперечним фактом є схожість їх з твердими тілами при температурах, близьких до температури кристалізації. Будучи фазою, проміжною між твердою і газоподібною, рідина, природно, знаходить безперервну гамму перехідних властивостей, примикаючи у області високих температур і великих питомих об'ємів до газів, а у області низьких температур і малих питомих об'ємів — до твердих тіл.
Особливості аморфного стану полягають у відсутності дальнього порядку і природної ізотропії властивостей. По структурі аморфні тіла нагадують рідини, а по характеру теплового руху — кристали. У аморфному стані можуть знаходитися як атомарні, так і молекулярні речовини.
Аналогія між структурами аморфних тіл і рідин не означає ідентичності існуючого в них ближнього порядку. Так, наприклад, рідкий: кремній і германій мають ближній порядок, істотно відмінний від ближнього порядку в аморфному стані. В той же час структура ланцюжка селену і теллура зберігається при переході з аморфного стану в рідкий. Різновидом аморфних тіл є стекла. Стеклоподібний стан речовини виходить з в'язкого розплаву при швидкому його охолоджуванні, тобто твердіє без кристалізації.
Кількісний опис рідини і аморфної речовини
В кристалічних тілах атоми, іони або молекули розташовані в певній послідовності, утворюючи тривимірну гратку. Вона складається з елементарних комірок, параметри яких можуть бути визначені експериментально по формулі Вульфа — Брегга:
2dsinи = nλ (6)
де θ — кут між площиною, що відображає, і падаючим пучком; d — міжплощіна відстань, пов'язана з трансляціями а, b, c кристалічної гратки і кутами α, β, γ між осями кристала. При температурі плавлення кристала його гратка руйнуються, зникає дальній порядок в розташуванні частинок, з'являється і складова трансляції теплового руху, унаслідок чого частково змінюється і характер ближнього оточення. У рідині встановлюється специфічний ближній порядок, поняття «міжплощинна відстань» втрачає сенс. Отже, і методи вивчення структури, засновані на рівнянні Вульфа — Брегга, до рідин непридатні.
Кількісний опис структури рідин і аморфних тіл здійснюється за допомогою радіальних функцій міжатомних відстаней, функцій атомної і молекулярної густини.
Нехай система з N однакових атомів займає об'єм V. Виберемо в ньому два елементи об'єму dV1 і dV2 що фіксуються векторами R1 і R2 проведеними з деякої точки (мал. 1.2).
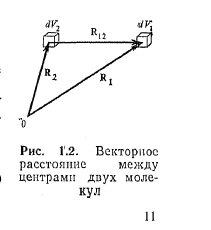
Якщо взаємне розташування атомів хаотичне, то вірогідність того, що атом 1 знаходиться в елементі об'єму dV1 а атом 2в той же час в dV2, через незалежність їх положень рівна:
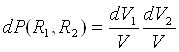 (7)
(7)
Хаотичне розташування атомів можливе лише в розріджених газах, коли власний об'єм атомів і сили взаємодії між ними можна не брати до уваги. У рідинах атоми не можуть знаходитися на довільній відстані один від одного, оскільки їх упаковка достатньо щільна. Вірогідність знаходження деякого атома в якій-небудь точці об'єму V залежить від того, в якій точці знаходиться інший атом. Такий вірогідний зв'язок між взаємним розташуванням атомів (їх кореляція) кількісно описується функцією W(R1,R2) Формулу (7) слід представити у вигляді:
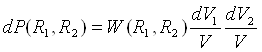 (8)
(8)
Оскільки рідини ізотропні, то функція W залежить тільки від взаємної відстані між парою даних атомів:
W(R1,R2) = W(|R1—R2|) = W(|R12|) = W(R) (1.9)
Рівність (8) можна виразити в іншій формі. Для цього сумістимо початок координат з центром атома 1 і опишемо навколо нього дві концентричні сфери радіусу R і R+dR .Вірогідністьвиявлення атома 2 в сферичному об'ємі 4πR2dR на відстані від R до R+dR від центру атома 1 рівна:
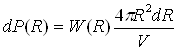 (10)
(10)
Функція W(R) задовольняє умові нормування:
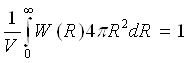 (11)
(11)
показуючому, що сума вірогідності знаходження даного атома на всіх можливих відстанях від фіксованого рівна одиниці. Функція W(R) називається радіальною функцією розподілу атомів або молекул. Її значення визначають вірогідність виявлення якого-небудь атома на відстані Rвід фіксованого атома. Оскільки сили відштовхування перешкоджають взаємному проникненню атомів, то в інтервалі 0 ≤ R < 2r ( r — радіус атома) функція W(R)= 0. При R→ ∞ вона прагне до одиниці.
Припустимо, що в шарі 4πR2dR знаходиться dn атомів. Тоді число атомів в одиниці об'єму цього шару визначиться формулою:
![]() (12)
(12)
У різних сферичних шарах число атомів неоднакове, тому ρ — це функція відстані R. Кількість атомів в одиниці об'єму може змінюватися і унаслідок міграції атомів між сусідніми положеннями рівноваги, тому dn є середнім за час спостереження значенням. Отже,
dn = ρ(R)4πR2dR (13)
Інтеграл 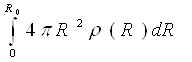 рівний числу атомів в об'ємі V, за винятком фіксованого атома. Якщо це число постійно, то в якості об'єму інтеграції приймається сфера, обмежена уявною поверхнею радіусу R0в необмеженому однорідному просторі.
рівний числу атомів в об'ємі V, за винятком фіксованого атома. Якщо це число постійно, то в якості об'єму інтеграції приймається сфера, обмежена уявною поверхнею радіусу R0в необмеженому однорідному просторі.
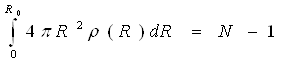 (14)
(14)
Якщо ж N флуктує навколо середнього значення
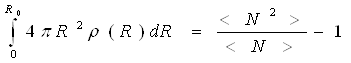 (15)
(15)
Її об'єм достатньо великий, щоб містити велике число атомів. При цьому передбачається, що атоми, розташовані поблизу поверхні сфери, мають те ж оточення, що і атоми, що знаходяться в її центрі. Співвідношення (14) і (15) визначають умови нормування функції атомної густини ρ(R) перша умова є точною для кристала, друга — для рідини. Зіставляючи функції (11) і (14), знаходимо
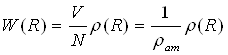 (16)
(16)
де ρат — середнє число атомів в одиниці об'єму. Згідно цьому співвідношенню значення W(R) рівні відношенню істинної кількості атомів в одиниці об'єму до середньої атомної густини. Тому W(R) має сенс відносної радіальній функції розподілу. Функція W(R) є найважливішою і основною характеристикою структури атомарних рідин і аморфних тіл.
Гази. Припустимо, що атоми — непроникні кульки. Тоді можна стверджувати, що вірогідність зближення двох атомів на відстань R<2r рівна нулю (мал. 1.3,а). Якщо густина газу дуже мала, то за межами сфери радіусу R = 2r розташування атомів по відношенню до фіксованого буде рівноімовірним (хаотичним). Число атомів в одиниці об'єму на цій відстані рівне середньому значенню ρат а функція W(R)= 1. Якщо ж газ достатньо щільний, то при R = 2r функція W(R) має максимум, при R<2r вона прагне до нуля, а при R>2r— до одиниці (мал. 1.3,6).
Кристали. У ідеальному кристалі за відсутності теплового руху атоми розташовані на фіксованих відстанях один від одного. Так, в кубічній гранецентрированій гратці 12 атомів знаходяться на відстані 2r, 6 — на відстані 2r(2)1/2, 24 — на відстані 2r(3)1/2 12 — на відстані 4r і т.д. Вірогідність знаходження атома в проміжках між вказаними відстанями рівна нулю. Якщо уявити собі, що такий кристал обертається навколо одного з атомів, то центри інших атомів розташовуватимуться на сферах цих радіусів і жоден з них не виявиться між сферами. Радіальна функція W(R) має дискретний характер. Якщо зберегти за нею умову нормування (11), то розподіл атомів на відповідних сферах можна представити у вигляді:
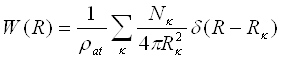 (17)
(17)
де δ(R—Rk) дельта-функція Дірака, числове значення якої визначають умовою 0 при R ≠ Rk
δ(R—Rk)= { ![]() (18)
(18)
∞ при R = Rk
Тепловий рух змінює розміщення атомів в кристалі, їх центри декілька відхиляються від середнього положення рівноваги. Тому вертикальні лінії (мал. 1.3, в) слід замінити піками гаусової форми з напівшириною ∆R = (kT/ β)1/2 де β — коефіцієнт квазіпружної сили.
Рідини. Амплітуда теплових коливань атомів біля положень рівноваги в рідині набагато більше, ніж в кристалах. До того ж атоми рідини, беручи участь в тепловому русі, безперервно обмінюються своїми найближчими сусідами. Якщо в думках прослідити за рухом якого-небудь атома в рідині, то можна переконатися, що за час спостереження він знаходитиметься на самих різних відстанях від фіксованого атома. Внаслідок цього функція W(R) буде безперервною. У інтервалі 2r
Функція W(R) є типовою для рідин з щільною упаковкою атомів (мал. 1.3,г). Якщо розташування атомів характеризується менш щільною упаковкою (вісмут, германій, сурма), то відповідна функція розподілу зображається кривою декілька іншого вигляду.
Зіставлення функцій W(R) для рідини і кристала показує, що у разі кристала максимуми цієї функції розділені проміжками, де, W(R)= 0, тоді як в рідині навіть перший пік не дозволений. Нерозв'язність піків радіальної функції зв'язана, очевидно, з розкидом рівноважних положень атомів і їх рухом трансляції. Якщо функція W(R) відома, то тим самим відомий і характер взаємного розташування частинок. Тому основною характеристикою молекулярної структури рідин є радіальна функція розподілу. Знаходження цієї функції для тієї або іншої рідини є найважливішою задачею структурного аналізу. Кількісними параметрами структури є координаційні числа, рівноважні міжатомні відстані, середні квадратичні зсуви атомів, а також відстань, на якому зникає кореляція в розташуванні частинок. Характеристиками структури рідин є також флуктуації концентрацій, густини і орієнтації молекул.
Дж. Кірквуд знайшов явний вид функції W(R) теоретично, виходячи із загальних принципів статистичної механіки. Імітуючи атоми твердими взаємодіючими кульками, він одержав формулу:
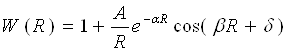 (19)
(19)
де A, α, β, і δ — постійні параметри. Наприклад, для аргону А = 9,51 Å; α = 0,30 Å -1; σ =2,12 Å -1; δ = —2,25. Функція W(R) обчислена по цій формулі, володіє такою ж залежністю від R як і експериментально визначувані функції розподілу для одноатомних щільно упакованих рідин.
Особливості розсіювання рентгенівського випромінювання, електронів і нейтронів
Рентгенографічні, електронографічні і нейтронографічні дослідження атомної і молекулярної структур рідин і аморфних тіл ґрунтуються на аналізі кутового розподілу інтенсивності розсіяного рентгенівського випромінювання, електронів і нейтронів. Розсіювання речовиною цих трьох видів випромінювань не однакове, що пояснюється відмінністю їх фізичної природи. Рентгенівське випромінювання розсівається електронами атомів і молекул. Процес розсіювання не характерний звичному віддзеркаленню або заломленню. Рентгенівське випромінювання, взаємодіючи з електронами, приводить їх в коливальний рух. Коливаючись з тією ж частотою, що і електричний вектор первинної електромагнітної хвилі, електрони породжують вторинне електромагнітне випромінювання, що розповсюджується на всіх напрямках. Інтенсивність розсіяного випромінювання, що фіксується в деякій точці, пропорційна електронній густині атомів і молекул.
Пучок прискорених електронів, що направляється на досліджувану речовину, розсівається електричним полем ядер і електронних оболонок атомів. Інтенсивність розсіювання електронів пропорційна електростатичному потенціалу атомів.
Нейтрони розсіваються ядрами атомів. При цьому пружне розсіювання повільних нейтронів використовується для вивчення атомної будови речовини, а непружне — для вивчення динаміки атомів і молекул.
Відмінність у взаємодії рентгенівського випромінювання електронів і нейтронів з речовиною враховується при розрахунку атомних амплітуд розсіювання, що є основними характеристиками розсіюючої здатності речовини. При розгляді ж розсіювання сукупністю зв'язаних атомів, іонів або молекул речовини механізм розсіювання не зачіпається. Беруть до уваги лише довжину хвилі використовуваного випромінювання, просторову конфігурацію частинок і відстань між ними.
Розсіювання рентгенівського випромінювання вільним електроном
Припустимо, що на вільний електрон направлений пучок паралельних монохроматичних рентгенівських променів, інтенсивність яких I0.Електрон під дією вектора електромагнітної хвилі здійснює коливання, випромінюючи вторинні хвилі. Кутовий розподіл інтенсивності цих хвиль залежить від стану поляризації первинного рентгенівського випромінювання. Якщо вони поляризовані, то інтенсивність розсіювання одним електроном, що фіксується в точці на відстані L від електрона, виражається формулою
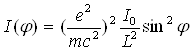 (20)
(20)
де m — маса електрона; e — його заряд; c — швидкість світла; φ — кут між напрямами коливання електрона і розсіюванням; e2/(mc2)— класичний радіус електрона, рівний 2,8•10-15м; (e2/(mc2))2— його поперечник розсіювання. З (20) видно, що із збільшенням кута φ інтенсивність розсіювання збільшується, досягаючи найбільшого значення при φ = 90° (мал. 2.1).
Якщо первинний пучок рентгенівського випромінювання неполяризований, то формула для інтенсивності розсіювання одним електроном набуває вигляду
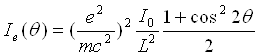 (21)
(21)
де (1+cos22θ)/2 = ρ(θ) — кутова залежність інтенсивності розсіяного рентгенівського випромінювання одним електроном названа поляризаційним чинником. Наявність цього множника у формулі (21) указує на те, що рентгенівське випромінювання при розсіянні частково поляризується. При гранично малих кутах розсіювання поляризаційний чинник рівний одиниці. Із збільшенням кута розсіювання цей чинник зменшується і при 2θ = 90° досягає значення, рівного 1/2. Таким чином, в різних напрямах інтенсивність розсіювання рентгенівського випромінювання одним електроном неоднакова. У напрямі первинного пучка і у зворотному напрямі інтенсивність розсіювання максимальна, а в перпендикулярному напрямі — мінімальна. Якщо у формулу (21) підставити значення постійних m, e і c то одержимо
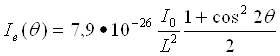 (22)
(22)
Отже, один вільний електрон розсіює в одиницю тілесного кута 10-26 частину інтенсивності первинного пучка. Це значення розсіюваної інтенсивності приймають за умовну одиницю і використовують для нормування кривих інтенсивності. Приведені формули справедливі для будь-якого електромагнітного випромінювання, у тому числі і для видимого світла, довжини хвиль якого набагато більше розміри атомів і молекул.
Проте у разі видимого світла хвилі, випромінювані атомами і молекулами, не інтерферують одна з одною, оскільки під дією світлової хвилі всі електрони атомів здійснюють коливання в однаковій фазі. Атоми і молекули в полі світлової хвилі поводяться подібно елементарним електричним диполям. Картина істотно змінюється, якщо довжина хвилі падаючого випромінювання менше розміру атома. Тепер уже електрони в різних частинах атома коливаються в неоднакових фазах. Випромінювані ними хвилі приходять в точку спостереження з деякою різницею фаз і інтерферують одна з одною. Результат цієї інтерференції залежить від числа електронів в атомі і їх просторового розподілу. Досвід показує, що не все розсіяне випромінювання має ту ж довжину хвилі, що і первинне. Деяка його частина розсівається атомами некогерентно і участі в інтерференції не бере. У структурному аналізі використовується тільки когерентне розсіювання.
Розсіювання рентгенівського випромінювання вільним атомом
Електрони в атомі не можна розглядати як вільні, тому інтенсивність розсіювання рентгенівського випромінювання атомом не може бути одержана простим складанням інтенсивностей розсіювання окремими електронами. При розрахунку інтенсивності розсіювання атомом необхідно враховувати різницю фаз вторинних хвиль, випромінюваних електронами в різних точках атома.
Розглянемо спочатку два електрони, що знаходяться в атомі в точках А і B на відстані r один від одного. Позначимо n і n0 — одиничні вектори у напрямі нормалі до фронту падаючої і розсіяної хвилі (мал. 2.2). Різниця ходу проміння, розсіяного електронами,
∆l = |AD|—|CB| = rcosβ—rcosβ0 = rn—rn0 = r(—0) (23)
де β0—кут між напрямом падаючого променя і вектором r ; β — те ж, для розсіяного променя. Якщо r(—0) = 2k(λ/2) те розсіяні хвилі підсилять одна одну, якщо ж r(—0) = (2k + 1) λ/2 те ослаблять. Рівняння (23) виражає умову інтерференції розсіяних хвиль
r(cosβ—cosβ0) = kλ (24)
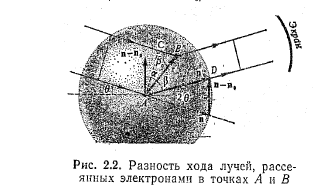
При k = 1 і β0 = 90° одержуємо cos β =λ/r . Оскільки cos β ≤ l, то звідси витікає, що інтерференція розсіяних хвиль виникає лише у разі, коли довжина хвилі менше відстані між частинками, що розсіюються. Якщо ж λ > r, інтерференція розсіяних хвиль не відбувається, Помноживши (23) на хвильове число 2π/ λ, одержимо вираз для різниці фаз хвиль, розсіяних двома електронами атома,
∆φ = (2π/ λ)r(—0) (25)
Припустимо, що електрони в атомі розподілені безперервно. Виділимо в ньому елемент об'єму dVi і позначимо ρe (ri) — електронну густину в точці на відстані riвід центру атома. Тоді число електронів, що знаходяться в об'ємі dVi визначиться величиною ρe(ri) dVi а амплітуда хвилі, розсіяної ними, — добутком
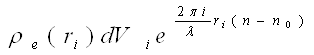
Сумарна амплітуда хвиль, розсіяних атомом,
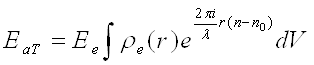 (26)
(26)
Вектор —0 співпадає з напрямом нормалі до площини, що відображає рентгенівське випромінювання. У атомі відбиваючих площин зрозуміло ні. Проте поняттям «нормаль до відбиваючої площини», ми користуватимемося і в даному випадку, оскільки вектор —0 визначає напрям осі, від якої відлічується полярний кут.
Якщо кут між напрямами первинного пучка і уявною площиною, що відображає, позначити θ, то кут розсіювання 2θ. Очевидно, що |—0 | = 2sinθ (мал.2.2) Позначаючи α — кут між векторами r і —0, одержимо для різниці фаз розсіяних хвиль вираз
![]() (27)
(27)
де S = (4π/λ)sinθ Параметр S, залежний від довжини хвилі і кута розсіювання, зустрічається в структурному аналізі і в теорії твердого тіла. Він пов'язаний з міжплощинною відстанню d для площин кристалічних граток, від яких походить віддзеркалення першого порядку під кутом θ при довжині хвилі λ.Згідно умові віддзеркалення 2dsinθ = λ , маємо
2sinθ/ λ = 1/d або 4πsinθ/ λ = 2π/d, тобто S = 2π/d (28)
З другого боку, параметр S пов'язаний з хвильовим вектором розсіяної хвилі співвідношенням
S = 2|k|sinθ (29)
а також з вектором оберненої гратки рівністю
S = 2π|r*| (30)
Підставляючи (27) в (26), одержимо для амплітуди розсіювання атомом вираз
![]() (31)
(31)
Щоб додати йому конкретніший вигляд, припустимо, що розподіл електронів в атомі сферично симетричний і ρ(r) залежить тільки від модуля вектора r, але не від його напряму. В цьому випадку елемент об'єму dV = r2drsinαdαdφ. Вираз (31) можна написати у вигляді
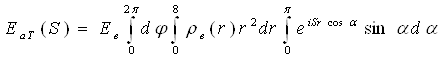 (32)
(32)
Інтегруючи (32) по α і φ, одержимо
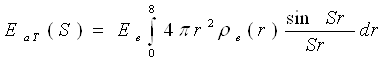 (33)
(33)
де 4πr2 ρe (r)dr — число електронів в сферичному шарі атома між радіусами r і r + dr .
Функція
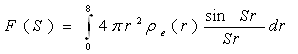 (34)
(34)
характеризує розсіюючу здатність атома і називається атомною амплітудою, а F2(S) — атомним чинником розсіювання. Числове значення F(S) показує, в скільки разів амплітуда розсіювання атомом в даному напрямі більше амплітуди розсіювання одним електроном. При S → 0 функція sinSr/(Sr) → 1; значення F(S) при нульовому куті розсіювання рівне числу електронів атома:
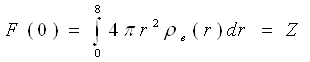 (35)
(35)
Отже, чим вище порядковий номер хімічного елементу, тим більше числове значення F(S). Із збільшенням параметра S функція F(S) монотонно убуває.
Щоб обчислити атомну амплітуду F(S) теоретично, потрібно знати просторовий розподіл електронної густини в атомі. Згідно квантової теорії, вірогідність знаходження електрона в точці на відстані r від центру атома визначається х