Органические полупроводники
1 Полупроводниковые материалы
1.1 Общие сведения о полупроводниках
1.2 Классификация полупроводников
1.3 Собственная проводимость полупроводников
1.4 Примесная проводимость полупроводников
2 Органические полупроводники
2.1 Общая характеристика группы органических полупроводников
2.2 Характеристика отдельных групп органических полупроводников
2.3 Электропроводность органических полупроводников
2.4 Электропроводность низкомолекулярных органических полупроводников
2.5 Электрические свойства полимерных полупрводников
2.6 Механизм электропроводности
2.7 Фотопроводимость органических полупроводников
2.8 Практическое применение органических полупроводников
Экспериментальная часть
Заключение
Список литературы
Физика полупроводников, раздел физики, в котором исследуются электрические, оптические, магнитные, тепловые и другие свойства полупроводниковых материалов – широкого класса неорганических и органических веществ – и структур на их основе. Свойства полупроводников сильно зависят от внешних воздействий, а также наличия атомов примеси и собственных дефектов структуры (кристал ли чес кой решетки). С открытия Фарадеем в 1833 г. полупроводниковых свойств у Ag2S их отличительным признаком остается увеличение концентрации носителей заряда при нагревании, которое приводит к уменьшению электрического сопротивления материала. В отличие от металлов (проводников электричества) для полупроводников характерна чувствительность к свету (фото про води мость, люминесценция), электрическому полю (не линей ные электрические свойства, электрический пробой), ионизирующему излучению (радиа ци он ная физика) и др. Полупроводники оптимально сочетают чувствительность к внешним воздействиям и возможность контролируемого формирования в них элементов с различающимися свойствами. Благодаря этому физика полупроводников служит научным фундаментом для опто-, микро- и наноэлектроники, во многом определяющих технический прогресс современного общества.
Изучение органических полупроводников вызывает сейчас наибольший интерес, так как с данными исследованиями связаны многие перспективные разработки, такие как создание OLED-дисплеев, светочувствительных материалов (например, для процессов записи информации), в микроэлектронике, для изготовления различного рода датчиков. Исследование полупроводников органических важно для понимания процессов преобразования и переноса энергии в сложных физико-химических системах и, в особенности в биологических тканях. С полупроводниками органическими, в частности с ион-радикальными солями, связана перспектива создания сверхпроводников с высокой критической температурой.
Таким образом, рассмотрение в качестве темы курсовой работы «Органические полупроводники» является актуальным.
Объектом исследования являются органические полупроводники. Предметом исследования являются конкретные свойства органических полупроводников.
Для решения поставленной цели необходимо решить следующие задачи:
- дать общую характеристику класса проводников, рассмотрев их классификацию, собственную и примесную проводимость;
- дать характеристику класса органических полупроводников, привести характеристику отдельных соединений относящихся к данному классу, рассмотреть особенности электропроводимости органических полупроводников.
- рассмотреть перспективы практического применения класса органических полупроводников, экспериментальные разработки в данной области.
С целью достижения вышеуказанных целей произвести анализ научно-методической литературы.
1.1 Общие сведения о полупроводниках
К классу полупроводников обычно относят большую группу твердых тел, удельная проводимость которых при комнатной температуре (T=300K) изменяется в очень широких пределах.
Числовое значение этой величины: (10-13-10-1 1/Oм.см) значительно выше, чем у изоляторов: (10-26-10-14 1/Oм.см), но намного ниже, чем у металлов: (1-102 1/Oм.см).
Если твердые тела классифицировать по механизму электропроводности, то нетрудно установить, что между полупроводниками и изоляторами не существует принципиального различия. Характерной особенностью полупроводников., отличающей их от металлов, является возрастание электропроводности s с ростом температуры, причём, как правило, в достаточно широком интервале температур возрастание происходит экспоненциально:
= 0ехр (-EA/кТ).(1.1.)
Здесь k — Больцмана постоянная, EA — энергия активации электронов в полупроводниках., (s0 — коэффициент пропорциональности (в действительности зависит от температуры, но медленнее, чем экспоненциальный множитель). С повышением температуры тепловое движение разрывает связи электронов, и часть их, пропорциональная exp (—EA/kT), становится свободными носителями тока.
Связь электронов может быть разорвана не только тепловым движением, но и различными внешними воздействиями: светом, потоком быстрых частиц, сильным электрическим полем и т.д. Поэтому для полупроводников характерна высокая чувствительность электропроводности к внешним воздействиям, а также к содержанию примесей и дефектов в кристаллах, поскольку во многих случаях энергия EAдля электронов, локализованных вблизи примесей или дефектов, существенно меньше, чем в идеальном кристалле данного полупроводника. Возможность в широких пределах управлять электропроводностью полупроводников изменением температуры, введением примесей и т. д. является основой их многочисленных и разнообразных применений.
Различают собственную и примесную проводимости полупроводников.
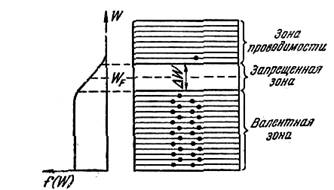
Рис.1
Важнейшее свойство полупроводников - возможность изменять свою электрическую проводимость под воздействием различных факторов: температуры, освещения, радиоактивного излучения и др.
Полупроводники представляют собой весьма многочисленный класс материалов. В него входят сотни самых разнообразных веществ – как элементов, так и химических соединений. Полупроводниковыми свойствами могут обладать как неорганические, так и органические вещества, кристаллические и аморфные, твердые и жидкие, немагнитные и магнитные. Несмотря на существенные различия в строении и химическом составе, материалы этого класса роднит одно замечательное качество- способность сильно изменять свои электрические свойства под влиянием небольших внешних энергетических воздействий. Одна из возможных схем классификации полупроводниковых материалов приведена на рис.2.
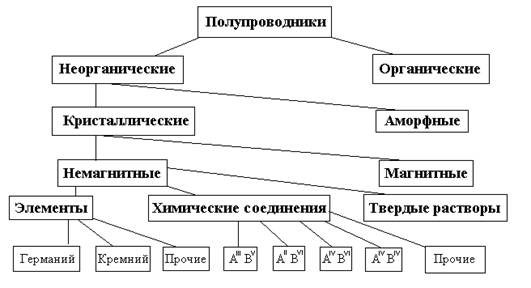
Рис. 2. Классификация полупроводниковыхматериалов по составу и свойствам.
Различие между полупроводниками и диэлектриками является скорее количественным, чем качественным. Формула (1.1) относится в равной мере и к диэлектрикам, электропроводность которых может стать заметной при высокой температуре. Точнее было бы говорить о полупроводниковом состоянии неметаллических веществ, не выделяя полупроводники в особый класс, а к истинным диэлектрикам относить лишь такие, у которых в силу больших значений EA и малых s0 электропроводность могла бы достигнуть заметных значений только при температурах, при которых они полностью испаряются.
1.2 Классификация полупроводников
Однако термин «Полупроводники» часто понимают в более узком смысле, как совокупность нескольких наиболее типичных групп веществ, полупроводниковые свойства которых четко выражены уже при комнатной температуре (300 К). Примеры таких групп:
1) Элементы IV группы периодической системы элементовМенделеева германий и кремний, которые как полупроводники пока наиболее полно изучены и широко применяются в полупроводниковой электронике. Атомы этих элементов, обладая 4 валентными электронами, образуют кристаллические решётки типа алмаза с ковалентной связью атомов, Сам алмаз также обладает свойствами полупроводника, однако величина EA для него значительно больше, чем у Ge и Si, и поэтому при Т = 300 К его собственная (не связанная с примесями или внешними воздействиями) электропроводность весьма мала.
2) Алмазоподобные полупроводники. К ним относятся соединения элементов III группы периодической системы (Al, Ga, In) с элементами V группы (Р, As, Sb), называются полупроводниками типа AIII BV (GaAs, InSb, GaP, InP и т.п.). Атомы III группы имеют 3 валентных электрона, а V группы — 5, так что среднее число валентных электронов, приходящееся на 1 атом, в этих соединениях равно 4 (как и у Ge и Si). Каждый атом образует 4 валентные связи с ближайшими соседями, в результате чего получается кристаллическая решётка, подобная решётке алмаза с той лишь разницей, что ближайшие соседи атома AIII — атомы BV а соседи атома BV — атомы AIII. За счёт частичного перераспределения электронов атомы AIII и BV в такой структуре оказываются разноимённо заряженными. Поэтому связи в кристаллах AIII BV не полностью ковалентные, а частично ионные. Однако ковалентная связь в них преобладает и определяет структуру, в результате чего эти кристаллы по многим свойствам являются ближайшими аналогами Ge и Si.
Соединения элементов II и VI групп периодической системы — AIIBVI (ZnTe, ZnSe, CdTe, CdS и т.п.) также имеют в среднем 4 валентных электрона на 1 атом, но ионная связь у них более сильно выражена. У некоторых из них ковалентная связь преобладает над ионной, у других она слабее, но и те и другие обладают свойствами полупроводников, хотя и не столь ярко выраженными, как в предыдущих группах.
Представление о «средней четырёхвалентности» и «алмазоподобных» полупроводниках оказалось плодотворным для поиска новых полупроводников, например типа AIIBIVC2V (ZnSnP2, CdGeAs2 и т.п.). Многие из алмазоподобных полупроводников образуют сплавы, которые также являются полупроводниками, например Ge — Si, GaAs — GaP и др.
3) Элементы VI и V групп и их аналоги. Элементы VI группы Te и Se как полупроводники были известны раньше, чем Ge и Si, причём Se широко использовался в выпрямителях электрического тока и фотоэлементах. Элементы V группы As, Sb и Bi — полуметаллы, по свойствам близкие к полупроводникам, а их ближайшие аналоги — соединения типа AIV и BVI (PbS, PbTe, SnTe, GeTe и т.п.), имеющие в среднем по 5 валентных электронов на атом, образуют одну из наиболее важных групп полупроводников, известную в первую очередь применением PbS, PbSe и PbTe в качестве приёмников инфракрасного излучения. Вообще среди соединений элементов VI группы (О, S, Se, Te) с элементами I—V групп очень много полупроводников. Большинство из них мало изучены. Примером более изученных и практически используемых могут служить Cu2O (купроксные выпрямители) и Bi2Te3 (термоэлементы).
4) Соединения элементов VI группы с переходными или редкоземельными металлами (Ti, V, Mn, Fe, Ni, Sm, Eu и т.п.). В этих полупроводниках преобладает ионная связь. Большинство из них обладает той или иной формой магнитного упорядочения (ферромагнетики или антиферромагнетики). Сочетание полупроводниковых и магнитных свойств и их взаимное влияние интересно как с теоретической точки зрения, так и для многих практических применений. Некоторые из них (V2O3, Fe3O4, NiS, EuO и др.) могут переходить из полупроводникового состояния в металлическое, причём превращение это происходит очень резко при изменении температуры.
Органические полупроводники. Многие органические соединения также обладают свойствами полупроводников. Их электропроводность, как правило, мала (s ~ 10-10 ом-1см-1) и сильно возрастает под действием света. Однако некоторые органические полупроводники. (кристаллы иполимеры на основе соединений тетрацианхинодиметана TCNQ, комплексы на основе фталоцианина, перилена, виолантрена и др.) имеют при комнатной температуре s, сравнимую с проводимостью хороших неорганических полупроводников.
Для изготовления полупроводниковых приборов используют как монокристаллы, так и поликристаллические материалы. Монокристаллы представляют собой более простые системы, с более совершенным строением, чем поликристаллические материалы. Они наиболее глубоко изучены, физические явления в них лучше поддаются расчетам, и они обеспечивают большую надежность и идентичность параметров полупроводниковых приборов.
В механизме электропроводности аморфных неорганических и кристаллических органических полупроводников выявлен ряд особенностей. Интерес к органическим полупроводникам вызван тем, что в некоторых из них полупроводниковые свойства сочетаются с эластичностью, которая позволяет изготавливать рабочие элементы в виде гибких лент и волокон.
1.3 Собственная проводимость полупроводников
Собственная проводимость. Собственная проводимость возникает в результате перехода электронов с верхних уровней валентной зоны в зону проводимости. При этом в зоне проводимости появляется некоторое число носителей тока — электронов, занимающих уров ни вблизи дна зоны; одновременно в валентной зоне освобождается такое же число мест на верхних уровнях. Такие свободные от электронов места на уровнях заполненной при абсолютном нуле валентной зоны называют дырками.
Распределение электронов по уровням валентной зоны и зоны проводимости определяется функцией Ферми. Вычисления показывают, что уровень Ферми лежит точно посредине запрещенной зоны (рис.1). Следовательно, для электронов, перешедших в зону проводимости, величина W—WF мало отличается от половины ширины запрещенной зоны. Уровни зоны проводимости лежат на хвосте кривой распределения. Поэтому вероятность их заполнения электронами можно находить по формуле
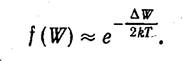 (1.2.)
(1.2.)
Количество электронов, перешедших в зону проводимости, будет пропорционально вероятности (1.2.). Эти электроны, а также образовавшиеся в таком же числе дырки, являются носителями тока.
Поскольку, проводимость пропорциональна числу носителей, она также должна быть пропорциональна выражению (1.2). Следовательно, электропроводность полупроводников быстро растет с температурой, изменяясь по закону
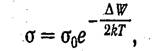 (1.3)
(1.3)
где ΔW—ширина запрещенной зоны.
Если на графике откладывать зависимость 1n σ от 1/T, то для полупроводников получается прямая линия, изображенная на рис. 2. По наклону этой прямой можно определить ширину запрещенной зоны ΔW.
Типичными полупроводниками являются элементы IV группы периодической системы Менделеева — германий и кремний. Они образуют решетку, в которой каждый атом связан ковалентными (парно-электронными) связями с четырьмя равноотстоящими от него соседними атомами. Условно такое взаимное расположение атомов можно представить в виде плоской структуры, изображенной на рис. 4. Кружки со знаком «+» обозначают положительно заряженные атомные остатки (т. е. ту часть атома, ко торая остается после удаления валентных электронов), кружки со знаком «—» — валентные электроны, двойные линии—ковалентные связи.
При достаточно высокой температуре тепловое дви жение может разорвать отдельные пары, освободив один электрон (такой случай показан на рис. 4).
Покинутое электроном место перестает быть нейтральным, в его окрестности возникает избыточный положи тельный заряд + е — образуется дырка. На это место может перескочить электрон одной из соседних пар. В результате дырка начинает также странствовать по кристаллу, как и освободившийся электрон.
Если свободный электрон встретится с дыр кой, они рекомендуют (соединяются). Это означает, что электрон нейтрализует избы точный положительный заряд, имеющийся в окрестности дырки, и теряет свободу передвижения до тех пор, пока снова не получит от кристаллической решетки энергию, достаточную для своего высвобождения. Рекомбинация приводит к одновременному исчезновению свободного электрона я дырки. На схеме уровней процессу рекомбинации соответствует переход электрона из зоны проводимости на один из свободных уровней валентной зоны.
Итак, в полупроводнике идут одновременно два процесса: рождение попарно свободных электронов и дырок и рекомбинация, приводящая к попарному исчезновению электронов и дырок. Вероятность первого процесса быстро растет с температурой. Вероятность рекомбинации пропорциональна как числу свободных электронов, так и числу дырок. Следовательно, каждой температуре соответствует определенная - равновесная концентрация электронов и дырок, величина которой изменяется с температурой по такому же закону, как и σ (см. формулу (1.2)).
В отсутствие внешнего электрического поля электроны проводимости и дырки движутся хаотически. При включении поля на хаотическое движение накладывается упорядоченное движение: электронов против поля и дырок — в направлении поля. Оба движения — и дырок, и электронов — приводят к переносу заряда вдоль кристалла. Следовательно, собственная электропроводность обусловливается как бы носителями заря да двух знаков— отрицательными электронами и положительными дырками.
Собственная проводимость наблюдается во всех без исключения полупроводниках при достаточно высокой температуре.
1.4 Примесная проводимость полупроводников
Этот вид проводимости возникает, если некоторые атомы данного полупроводника заменить в узлах кристаллической решетки атома ми, валентность которых отличается на единицу от валентности основных атомов. На условно изображена решетка германия с приме сью 5-валентных атомов фосфора. Для образования ковалентных связей с соседями атому фосфора достаточно четырех электронов. Следовательно, пятый валентный электрон оказывается как бы лишним и легко отщепляется от атома за счет энергии теплового движения, образуя странствующий свободный электрон. В отличие от рассмотренного раньше случая образование свободного электрона не сопровождается нарушением ковалентных связей, т. е. образованием дырки. Хотя в окрестности атома примеси возникает избыточный положи тельный заряд, но он связан с этим атомом и перемещаться по решетке не может. Благодаря этому заряду атом примеси может захватить приблизившийся к нему электрон, но связь захваченного электрона с атомом бу дет непрочной и легко нарушается вновь за счет тепловых колебаний решетки.
Таким образом, в полупроводнике с 5-валентной примесью имеется только один вид носителей тока — электроны. Соответственно говорят, что такой полупроводник обладает электронной проводимостью или является полупроводником n-типа (от слова negativ — отрицательный). Атомы примеси, поставляющие электроны проводимости, называются донорами.
Примеси искажают поле решетки, что приводит к возникновению на энергетической схеме так называемых локальных уровней, расположенных в запрещен ной зоне кристалла (рис. 6). Любой уровень валентной зоны или зоны проводимости может быть занят электроном, находящимся в любом месте кристалла.
Энергию, соответствующую локальному уровню, электрон может иметь, лишь находясь вблизи атома примеси, вызвавшего появление этого уровня. Следовательно, электрон, занимающий примесный уровень, локализован вблизи атома примеси.
Если донорные уровни расположены недалеко от потолка валентной зоны, они не могут существенно повлиять на электрические свойства кристалла. Иначе обстоит дело, когда расстояние таких уровней от дна зоны проводимости гораздо меньше, чем ширина запрещенной зоны, В этом случае энергия теплового движения даже при обычных температурах оказывается достаточной для того, чтобы перевести электрон с донорного уровня в зону проводимости. На этому процессу соответствует отщепление пятого валентного электрона от атома примеси. Захвату свободного электрона атомом примеси соответствует на рис. 6 переход электрона из зоны проводимости на один из донорных уровней.
Уровень Ферми в полупроводнике n-типа лежит между донорными уровнями и дном зоны проводи мости, при невысоких температурах — приблизительно посредине между ними
На условно изображена решетка кремния с примесью 3-валентных атомов бора. Трех валентных электронов атома бора недостаточно для образования связей со всеми четырьмя соседями. Поэтому одна из связей окажется неукомплектованной и будет представлять собой место, способное захватить электрон. При переходе на это место электрона одной из соседних пар возникнет дырка, которая будет кочевать по кристаллу. Вблизи атома примеси возникнет избыточный отрицательный заряд, но он будет связан с данным атомом и не может стать носителем тока. Таким образом, в полупроводнике с 3-валентной примесью возникают носители тока только одного вида — дырки. Проводимость в этом случае называется дырочной, а о полупроводнике говорят, что он принадлежит к p-типу (от слова positiv — положительный). Примеси, вызывающие возникновение дырок, называются акцепторными.
На схеме уровней акцептору соответствует расположенный в запретной зоне недалеко от ее дна локальный уровень. Образованию дырки отвечает переход электрона из валентной зоны на акцепторный уровень. Обратный переход соответствует разрыву одной из четырех ковалентных связей атома примеси с его соседями и рекомбинации образовавшегося при этом электрона и дырки.
Уровень Ферми в полупроводнике р-типа лежит между потолком валентной зоны и акцепторными уровнями, при невысоких температурах — приблизительно посреди не между ними.
С повышением температуры концентрация примесных носителей тока быстро достигает насыщения. Это означает, что практически освобождаются все донорные или заполняются электронами все акцепторные уровни. Вместе с тем по мере роста температуры все в большей степени начинает сказываться собственная проводимость полупроводника, обусловленная переходом электронов непосредственно из валентной зоны в зону проводимости. Таким образом, при высоких температурах проводимость полупроводника будет складываться из примесной и собственной проводимости. При низких температурах преобладает примесная, а при высоких — собственная проводимость.
2.1 Общая характеристика группы органических полупроводников
Полупроводники органические, твёрдые органические вещества, которые имеют (или приобретают под влиянием внешних воздействий) электронную или дырочную проводимости. Полупроводники органические характеризуются наличием в молекулах системы сопряжения. Носители тока в полупроводниках органических образуются в результате возбуждения p-электронов, делокализованных по системе сопряжённых связей. Энергия активации, необходимая для образования носителей тока в полупроводниках органических, снижается по мере увеличения числа сопряжений в молекуле и в полимерах может быть порядка тепловой энергии.
К полупроводникам органическим относятся органические красители (например, метиленовый голубой, фталоцианины), ароматические соединения (нафталин, антрацен, виолантрен и др.), полимеры с сопряжёнными связями, некоторые природные пигменты (хлорофилл, b-каротин и др.), молекулярные комплексы с переносом заряда, а также ион-радикальные соли. Полупроводники органические существуют в виде монокристаллов, поликристаллических или аморфных порошков и плёнок. Величины удельного сопротивления r при комнатной температуре у полупроводников органических лежат в диапазоне от 1018ом×см (нафталин, антрацен) до 10-2 ом×см. Наиболее проводящими полупроводниками органическими являются ион-радикальные соли, на основе анион-радикала тетрацианхинодиметана. Они обнаруживают электропроводность металлического характера. У полупроводников органических с низкой электропроводностью наблюдается явление фотопроводимости.
Полупроводники органические обладают особенностями, которые определяются молекулярным характером их структуры и слабым межмолекулярным взаимодействием:
1) поглощение света вызывает возбуждение молекул, которое может мигрировать по кристаллу в виде экситонов
2) образование носителей тока под действием света связано с распадом экситонов на поверхности кристалла, дефектах его структуры, примесях, при взаимодействии экситонов друг с другом, а также с автоионизацией высоковозбуждённых молекул;
3) зоны проводимости узки (~0,1 эв), подвижность носителей тока, как правило, мала (~1 см2/в×сек)
4) наряду с зонным механизмом электропроводности осуществляется прыжковый механизм.
В кристаллах ион-радикальных солей межмолекулярное взаимодействие сильно анизотропно, что приводит к высокой анизотропии оптических и электрических свойств и позволяет рассматривать этот класс полупроводники органические как квазиодномерные системы.
Полупроводники органические находят применение в качестве светочувствительных материалов (например, для процессов записи информации), в микроэлектронике, для изготовления различного рода датчиков. Исследование полупроводников органических важно для понимания процессов преобразования и переноса энергии в сложных физико-химических системах и в особенности в биологических тканях. С полупроводниками органическими, в частности с ион-радикальными солями, связана перспектива создания сверхпроводников с высокой критической температурой.
2.2 Характеристика отдельных групп органических полупроводников
1. Красители, цветные органические соединения, применяемые для окраски текстильных материалов, кожи, мехов, бумаги, пластмасс, резин, древесины и др. К ним относятся также бесцветные соединения, из которых окрашенные вещества образуются после нанесения на материал, например красители для холодного крашения, а также отбеливатели оптические. Природные красители — ализарин, индиго и др. — добывались с глубокой древности из растений, реже из животных организмов. Первые синтетические красители получены в 1856 независимо польским химиком Я. Натансоном (фуксин) и английским химиком У. Г. Перкином (мовеин), а в 1857 начато промышленное производство мовеина. В 1869 синтезирован ализарин (немецкие химиками К. Гребе и К. Т. Либерманом) и вскоре большое число др. синтетических красителей, превосходящих по качеству природные. К началу 20 в. синтетические красители почти полностью вытеснили натуральные. Синтез красителей стал возможным после открытия Н. Н. Зининым общего метода получения ароматических аминов. К началу 70-х гг. число красителей, выпускавшихся промышленностью всего мира, превышало 9000 и ежегодно растет.
По химическому строению красители разделяют на следующие группы: нитрокрасители, нитрозокрасители, азокрасители, арилметановые, хинониминовые красители, сернистые красители, индигоидные красители, антрахиноновые красители, полициклические красители, фталоцианиновые красители, полиметиновые красители, азометиновые красители. По областям и методам применения красители делят на кислотные, прямые, кубовые, сернистые, протравные, основные, катионные, активные (реактивные), окислительные, дисперсные, пигменты и лаки, жиро-, спирто- и ацетонорастворимые, красители для холодного (ледяного) крашения, для кожи, алюминия, меха, дерева и др.
Цветность красителей, т. е. способность избирательно поглощать видимые лучи света, связана с их химическим строением: наличием достаточно протяжённой системы сопряжённых двойных связей, часто включающей гетероатомы. На окрашиваемом материале (субстрате) красители удерживаются благодаря образованию химических связей с субстратом: ковалентных (в случае активных красителей) или ионных (для кислотных красителей), а также силами адсорбции и водородной связи (прямые красители); многие красители образуют нерастворимые в воде частицы (кубовые, сернистые красители, красители для холодного крашения), которые «застревают» в порах субстрата; для удержания красители на окрашиваемом материале применяют также связующие или плёнки полимера. В процессе эксплуатации материала его окраска не должна существенно изменяться под действием света, слабых кислот и щелочей, при стирке, трении, глаженье и т. п. Устойчивость окраски зависит от многих факторов, в том числе от химического строения красителя, характера связи красителя с субстратом и природы последнего. Так, например, основные красители нестойки на шерсти, но достаточно прочны на полиакрилонитрильном волокне. Устойчивость окрасок к различным воздействиям измеряется по пятибалльной системе, кроме светопрочности, которая оценивается по восьмибалльной шкале.
Помимо окраски различных материалов, красители применяют в цветной и черно-белой кинематографии и фотографии, аналитической химии, в медицине в качестве средств диагностики, при биохимических исследованиях, в жидкостных лазерах, в различных физических приборах в качестве элементов, обладающих фотопроводимостью и некоторыми др. свойствами.
Сырьём для производства красителей служат бензол, нафталин, антрацен, пирен и др. ароматические и гетероциклические соединения, а также различные кислоты, щёлочи, соли, спирты и др. вещества. Сначала получают так называемые промежуточные продукты, которые далее превращают в красители посредством реакций конденсации, диазотирования, азосочетания, окисления и др. производство многих красителей отличается сложностью, процесс иногда состоит из 10 и более стадий.
2. Хлорофилл (от греч. chlorós — зелёный и phýllon — лист), зелёный пигмент растений, с помощью которого они улавливают энергию солнечного света и осуществляют фотосинтез. Локализован в особых клеточных структурах — хлоропластах или хроматофорах и связан с белками и липидами мембран. Основу структуры молекулы Х, составляет магниевый комплекс порфиринового цикла; в IV пиррольном кольце к остатку пропионовой кислоты присоединён высокомолекулярный спирт фитол, который придаёт Х. способность встраиваться в липидный слой мембран хлоропластов.
Высшие растения и зелёные водоросли содержат Х. а и в, бурые и диатомовые водоросли — а и с, красные водоросли — Х. а и d. В фотосинтезирующих бактериях присутствуют близкие аналоги Х. — бактериохлорофиллы. По своему строению Х. близок к др. природным комплексам порфиринов (с железом) — дыхательным пигментам — цитохромам, красящему веществу крови — гему, а также простетическим группам некоторых ферментов — пероксидазы, каталазы.
Название «Х.» было дано французскими химиками П. Пельтье и Ж. Каванту зелёному спиртовому раствору смеси растительных пигментов в 1817. Впервые Х. а и в разделил в начале 20 в. русским учёный М. С. Цвет с помощью разработанного им хроматографического метода. Химическую структуру Х. выяснили немецкие учёные Р. Вильштеттер,А. Штоль (1913), Х. Фишер (1930—40). Полный синтез Х. осуществил американский химик Р. Вудворд. Роль Х. в фотосинтезе доказана классическими работами К.А. Тимирязева. Пути биосинтеза Х. выяснены в трудах американских учёных Д. Шемина, С. Граника и др.; большой вклад в изучение Х. внесли советские учёные Т.Н. Годнев и А.А. Шлык.
Основной путь биосинтеза Х. определяется конденсацией двух молекул d-аминолевулиновой кислоты с образованием порфобилиногена — производного пиррола, который в результате ряда ферментативных превращений даёт соединение, содержащее порфириновое ядро — протопорфирин IX. Из протопорфирина образуется непосредственный предшественник Х. — протохлорофиллид, уже содержащий атом магния. Путём последующих реакций восстановления и присоединения фитола из этого предшественника образуется Х. Стадия восстановления протохлорофиллида осуществляется у высших растений на свету, у низших растений — в темноте.
В хлоропластах и хроматофорах большая часть Х. (содержание его обычно составляет 0,5—1,5% на сухую массу) находится в виде светособирающей «антенны» и меньшая часть — в реакционных центрах, непосредственно участвующих в работе цепи фотосинтетического переноса электрона. Поглощая квант света, молекула Х. переходит в возбуждённое состояние (длительность жизни синглетного возбуждённого состояния около 10-9сек), которое может переходить в долгоживущее триплетное возбуждённое состояние с длительностью жизни до 10-3сек. Возбуждённые светом молекулы Х. способны переносить электрон от молекулы-донора к молекуле-акцептору. Механизм этих реакций в модельных системах выяснен в работах советских учёных А.А. Красновского, В.Б. Евстигнеева и др. Способность возбуждённого Х. к переносу электрона обеспечивает функционирование реакционных центров фотосистем цепи фотосинтетического переноса электрона. Применение спектральной техники и низких температур показало, что в первичном фотоакте бактериохлорофилл, а возможно, и Х. активного центра отдают свой электрон молекуле-акцептору (убихинон, ферредоксин). Этот первичный фотопроцесс сопряжён с цепью энзиматических реакций, ведущих к образованию восстановленных пиридиннуклеотидов и аденозинтрифосфата, обеспечивающих работу углеродного цикла. Т. о., свет, поглощённый Х., преобразуется в потенциальную химическую энергию органических продуктов фотосинтеза и молекулярного кислорода. Свет, поглощаемый Х., вызывает в клетках также др. фотобиологические явления: индуцирует генерацию электрического потенциала на мембранах хлоропластов, влияет на движение одноклеточных организмов (фототаксис) и т.д.
Исследованию свойств Х. на разных уровнях молекулярной организации уделяется большое внимание, т.к. эти свойства тесно связаны с фундаментальным явлением преобразования энергии света в химическую энергию при фотосинтезе.
2.3 Электропроводность органических полупроводников
Изучение неорганических и органических полупроводников показало, что в них возникают следующие виды зарядоносителей:
а) атомы, которые, потеряв свой электрон с внешней оболочки, становятся положительно заряженными частицами и участвуют в переносе положительных зарядов;
б) освобожденные при этом изменении электроны, которые становятся
носителями зарядов;
в) ионизированные атомы-акцепторы, т.е. атомы, захватившие у соседнего атома электрон; они тоже являются отрицательно заряженными
частицами и участвуют в переносе отрицательных частиц;
г) дырки, образовавшиеся при захвате у атома валентных электронов; они начинают притягивать электроны от соседнего атома и становятся своеобразными носителями положительного электричества.
Значительно больше видов движения зарядоносителей у органических полупроводников. Здесь их перемещение представляет собой совмещение сложных
явлений, одно из которых обусловлено «блуждающими» по молекуле электронами.Так как молекулы различны, то и связи их с электроном различны.
Электрическое поле, в которое помещен полупроводник, вызывает направленное движение носителей (дрейф), обусловливающее протекание тока в полупроводнике.
Основным для круга вопросов, связанных с прохождением электрического тока в полупроводнике, является понятие подвижности носителей m, определяемое, как отношение средней скорости направленного их движения (скорости дрейфа), вызванного электрическим полем uд, к напряжённости Е этого поля:
m = uд/Е (2.1)
Подвижности разных типов носителей в одном и том же полупроводнике различны, а в анизотропных полупроводниках различны и подвижности каждого типа носителей для разных направлений поля. Дрейфовая скорость, возникающая в электрическом поле, добавляется к скорости теплового хаотического дви