Эмульсии и эмульгаторы
Реферат
по биологии
на тему:
«Эмульсии и эмульгаторы»
2009
Эмульсии — дисперсии одной жидкости в другой
Эмульсии представляют собой дисперсии одной жидкости в другой, при этом очевидно, что эти две жидкости не смешиваются друг с другом. Почти все эмульсии содержат воду в качестве одной из фаз и органическую жидкость в качестве другой фазы. Органическую фазу принято называть «маслом», но это не означает, что она обязательно является маслом в прямом значении этого слова. Встречаются эмульсии и не содержащие воды, например эмульсии фторуглеродов в углеводороде. Можно привести примеры эмульсий, состоящих из двух водных фаз. В таких эмульсиях обе фазы обычно являются растворами двух разных полимеров, например декстрана и полиэтиленгликоля.
Эмульсии можно разделить на два основных типа: «масло в воде» и «вода в масле». Распространенными примерами эмульсий первого типа являются краски, клеи, битумные эмульсии, композиции для сельскохозяйственных нужд и т. д. Примером эмульсий второго типа служат маргарины. Существуют также двойные эмульсии, которые могут быть двух типов: «вода в масле» в воде или «масло в воде» в масле. Такие эмульсии представляют интерес как средства доставки лекарственных веществ. Капли жидкости в эмульсиях образуют дисперсную фазу, а окружающая их жидкость — дисперсионную среду.
Если масло диспергировано в воде без добавок поверхностно-активных веществ или каких-либо стабилизаторов других типов, устойчивость эмульсии очень низкая. Капли масла сталкиваются друг с другом, что вызывают их слияние, т. е. коалесценцию. Скорость движения индивидуальных капель под действием гравитационных сил пропорциональна разнице плотностей дисперсной фазы и дисперсионной среды, а также квадрату радиуса капель и обратно пропорциональна вязкости дисперсионной среды. Для типичной эмульсии углеводорода в воде расчеты показывают, что скорость движения капель размером 0.1 мкм равна 0.4 мм/сутки, капель размером 1 мкм - 40 мм/сутки, а капли размером 10 мкм седиментируют уже со скоростью 4 м/сутки. Отсюда следует, насколько важно получать эмульсии с каплями малого размера.
Кроме того, расчеты показывают, что полупериод жизни капли масла радиусом 1 мкм в эмульсии «масло в воде», содержащей равные объемы масла и воды, при вязкости воды равной 1 мПа-с, составляет 0.77 с.
Для эмульсий, сохраняющихся в течение шести месяцев, полупериод жизни равен 1.6-10 с. Сравнение приведенных значений не оставляет сомнений в том, что капли в эмульсиях необходимо стабилизировать. Ниже рассмотрены несколько способов стабилизировать эмульсии.
Высококонцентрированные эмульсии
В большинстве эмульсий, предназначенных для технологического применения, концентрация дисперсной фазы составляет 25-50%. Вязкость таких эмульсий практически не отличается от вязкости дисперсионной среды. Поскольку высокая вязкость дисперсионной среды способствует устойчивости эмульсий, сложилась практика вводить в дисперсионную среду полимеры или другие добавки, увеличивающие вязкость этой фазы.
В монодисперных эмульсиях с 50%-ной концентрацией дисперсной фазы наблюдается почти плотная упаковка капель. На самом деле частицы в таких эмульсиях часто находятся во втором минимуме. Теоретический максимум для статистической упаковки сфер — 64% внутренней фазы, а для гексагональной упаковки — 74%. Тем не менее эмульсии могут содержать более 90 об.% дисперсной фазы. Для сферических частиц это возможно при широком распределении частиц по размерам, что позволяет маленьким каплям заполнять «пустоты» между большими каплями. Примером таких концентрированных, важных с технологической точки зрения эмульсий являются эмульгированные взрывчатые вещества. Обычно это эмульсии типа «вода в масле», содержащие до 90% воды, в которой растворен нитрат аммония. Нитрат аммония окисляет углеводород с образованием газообразных продуктов, что сопровождается резким возрастанием объема.
В экстремальных случаях эмульсии могут содержать 99% дисперсной фазы, такие эмульсии имеют гелеобразный вид, а их структура больше похожа на полиэдрическую структуру концентрированных пен, чем на сферическую форму капель и пузырьков.
Механизмы разрушения эмульсий
За разрушение эмульсий отвечают разные механизмы. Отстаивание или седиментация происходят из-за разницы плотностей дисперсной фазы и дисперсионной среды. Отстаивание наблюдается чаще, чем седиментация, поскольку более распространены эмульсии типа «масло в воде», а плотность масляной фазой меньше плотности водной фазы. У некоторых масел плотность больше, чем у воды, поэтому добавление таких растворителей к масляной фазе используется для повышения стабильности эмульсий, требующих длительного хранения. Капли в эмульсиях могут также флокулировать, а это означает, что система будет находится во «вторичном минимуме». В этом случае система находится в энергетически устойчивом состоянии, в котором капли максимально сближены друг с другом, но сохраняют свою целостность. Отстаивание, седиментация и флокуляция являются обратимыми процессами. Это значит, что при определенных условиях систему можно вернуть в исходное состояние, например при наложении сдвиговых нагрузок. Гораздо более глубокие изменения в эмульсиях вызывает процесс коалесценции, при котором капли сливаются друг с другом. Коаленценцию можно рассматривать как необратимый процесс. В ряде случаев, если вторичный минимум невелик или вовсе отсутствует, разделить процессы флокуляции и коалесценции практически невозможно.
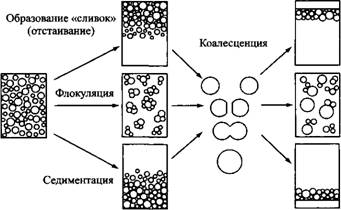
Рис. 1. Механизмы дестабилизации эмульсий. Обратите внимание, что различные процессы могут происходить одновременно
Существует еще один механизм дестабилизации эмульсий — это оствальдово созревание. В этом процессе из маленьких капель, следовательно, капель с большим соотношением площади и объема, уходит вещество, и в конце концов эти капли исчезают, в то время как более крупные капли увеличиваются в размере. Процесс осуществляется за счет диффузии молекул дисперсной фазы через дисперсионную среду. Скорость оствальдова созревания в эмульсиях типа «масло в воде» зависит от растворимости масла в воде, поэтому процесс гораздо заметнее для эмульсий низших углеводородов а не высших углеводородов.
При обсуждении стабилизации эмульсий можно провести параллель со стабилизацией дисперсий, содержащих твердые частицы, т. е. суспензий. В суспензиях обычно плотность частиц дисперсной фазы больше, чем плотность дисперсионной среды, поэтому для них характерен процесс седиментации, а не всплывания капель. Процессы флокуляции также присущи суспензиям; как и в случае эмульсий, благодаря флокуляции суспензия оказывается во вторичном минимуме, что подразумевает обратимость системы. Рано или поздно частицы твердой фазы необратимо агрегируют, что эквивалентно процессу коалесценции в эмульсиях. Если частицы дисперсной фазы в какой-то мере растворимы в воде, как, например, большинство солей и оксидов, в результате оствальдова созревания постепенно увеличивается размер частиц дисперсной фазы, причем часто процесс заканчивается образованием суспензии с более узким распределением частиц по размерам.
Необходимость потенциального энергетического барьера для капель в эмульсиях
Как упоминалось выше, полупериод жизни стандартной эмульсионной капли радиусом 1 мкм не превышает 1 с. Если на поверхности создается потенциальный энергетический барьер, время жизни может увеличиться до нескольких дней и даже лет. Можно показать, что энергетический барьер, равный 10 кТ {к — константа Больцмана, T— абсолютная температура) на расстоянии радиуса от частицы, обеспечивает повышение времени жизни капли до 2 ч, а барьер в 15 кТ— до 1.3 сут. Увеличение барьера до 20 кТ приводит к увеличению полупериода жизни капли до 5 лет. Таким образом, потенциальный барьер имеет принципиальное значение для стабильности эмульсий. Зададимся вопросом, как можно создавать такие барьеры?
Принято различать следующие механизмы стабилизации эмульсий, несмотря на то, что реально они часто комбинируются.
Электростатическая стабилизация
Электростатическая стабилизация эмульсий с помощью ионных поверхностно-активных веществ очень широко распространена. Кроме того, для этой цели можно использовать полиэлектролиты. Электростатическая стабилизация основана на отталкивании, которое возникает при перекрывании двойных электрических слоев, существующих вокруг частиц. В результате перекрывания в этой зоне повышается концентрация ионов, что приводит к проигрышу в энтропии.
Стерическая стабилизация
Стерическая стабилизация достигается с помощью неионных поверхностно-активных веществ с длинными полиоксиэтиленовыми цепями. Неионные полимеры также часто используются для обеспечения стерической стабилизации. Для обеспечения эффективной стерической стабилизации необходимо выполнять следующее требование: дисперсионная среда должна быть хорошим растворителем для полимерных цепей, которые распространяются от поверхности в окружающую среду. Такой растворитель должен быть «лучше, чем тета-растворитель». Стерическая стабилизация обусловлена отталкиванием, возникающим вследствие понижения энтропии, когда полимерные цепи от двух капель начинают перепутываться.
На рис. 2 проиллюстрированы электростатическая и стерическая стабилизации, обеспечиваемые анионными и неионными поверхностно-активными веществами соответственно.
Стабилизация эмульсий твердыми частицами
Для стабилизации эмульсий можно использовать твердые частицы. Частицы должны быть малы по сравнению с каплями эмульсии и достаточно гидрофобны. Наилучший эффект достигается, когда частицы образуют с каплями масла краевой угол -90°. Такие частицы считаются сбалансированными, поскольку они в равной мере погружены в обе жидкие фазы. Гидрофобные белки, часто белки в изоэлектрической точке, могут действовать аналогичным образом.
Стабилизация ламелярными жидкими кристаллами
Поверхностно-активные вещества могут образовывать вокруг капель мультислои с образованием ламелярной жидкокристаллической фазы. Эти многослойные структуры стабильны и могут обеспечивать очень большое время жизни эмульсий. В случае стабилизации жидкокристаллической фазой затрачивается минимальная энергия для получения эмульсий. Это так называемое «спонтанное эмульгирование». На рис. 4 показаны ламелярные жидкие кристаллы на поверхности капли масла.
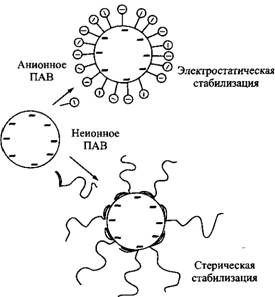
Рис. 2. Электростатическая и стерическая стабилизация эмульсии поверхностно-активными веществами
Комбинация механизмов стабилизации
Как упоминалось ранее, в стабилизации эмульсий часто проявляется несколько механизмов. Во многих системах сочетаются электростатическая и стерическая стабилизация; в этом случае иногда говорят об «электростерической» стабилизации. Например, такая стабилизация происходит в эмульсиях технического назначения, стабилизированных этоксилированными жирными спиртами и додецилсульфатом натрия.
Рис. 3. Стабилизация эмульсии твердыми маленькими частицами
Рис. 4. Стабилизация эмульсии ламелярной жидкокристаллической фазой
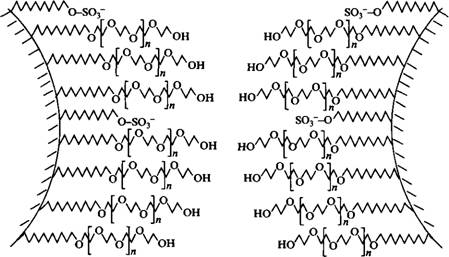
Рис. 5. Стабилизация эмульсии «масло в воде» смесью этоксилированного спирта и додецил-сульфата натрия
Бутербродные масла, будучи эмульсиями типа «вода в масле», могут быть устойчивыми за счет трех механизмов стабилизации: анионные фос-фолипиды обеспечивают электростатическую стабилизацию, биополимеры — стерическую, а кристаллы жира — стабилизацию твердыми частицами.
Теория ДЛФО — краеугольный камень в понимании стабилизации эмульсий
Теория ДЛФО, названная в честь четырех разработавших ее ученых — Деряги-на, Ландау, Фервея и Овербека, — описывает картину взаимодействия между ван-дер-ваальсовым притяжением и отталкиванием двойных электрических слоев. Между этими силами существует конкуренция, что и определяет устойчивость дисперсных систем. Притяжение преобладает на коротких и на больших расстояниях между частицами. На промежуточных расстояниях отталкивание двойных электрических слоев, обеспеченное сильно заряженными поверхностями при не очень больших концентрациях электролита в дисперсионной среде, может превосходить силы притяжения. Соли экранируют заряды на поверхности частиц и таким образом снижают устойчивость эмульсий. Теория ДЛФО предсказывает, а эксперименты подтверждают, что при концентрации соли 0.1 M электростатическое отталкивание нивелируется. Электростатическая стабилизация может быть чрезвычайно эффективной в модельных системах, в то же время чувствительность к электролитам оказывается серьезным препятствием использования эмульсий для множества практических целей.
На рис. 6 показаны кривые энергии взаимодействия для двух ситуаций. Энергия притяжения одинакова в обоих случаях, а электростатическое отталкивание сильное и слабое. Результирующая кривая J7 имеет максимум отталкивания, а на кривой V такой максимум отсутствует.
Теория ДЛФО и наиболее общие концепции стабилизации эмульсий и их дестабилизации приложимы и к дисперсным системам, в которых дисперсная фаза представлена твердыми частицами, т.е. к суспензиям. Обычно суспензии характеризуются большой разностью плотностей дисперсной фазы и дисперсионной среды, что сильно затрудняет их стабилизацию. Однако твердые частицы часто оказываются сильнее заряженными по сравнению с каплями эмульсий, что способствует стабилизации. В особо важных ситуациях для стабилизации каждой индивидуальной системы, эмульсии или суспензии, разрабатываются специальные композиции. Но в любом случае все системы имеют одно общее свойство: они термодинамически неустойчивы. Рано или поздно, иногда спустя годы хранения эмульсии и суспензии разделяются на макроскопические фазы.
У эмульсий также много общих свойств с пенами. Они являются дисперсными системами, состоящими из полярной фазы, например воды, и неполярной фазы — масла или воздуха. Для получения тонкодисперсных систем с большой межфазной поверхностью необходимо использовать низкомолекулярные ПАВ — эмульгаторы или пенообразователи. Оба типа дисперсий можно стабилизировать с помощью высокомолекулярных веществ или твердых частиц, которые аккумулируются на межфазной границе. Кроме того, механизмы дестабилизации пен и эмульсий имеют много общего, поэтому реагенты, использующиеся для дестабилизации, часто оказываются одними и теми же.
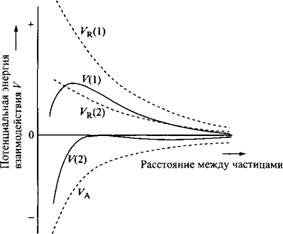
Рис. 6. Потенциальная энергия взаимодействия как функция расстояния между частицами для случаев сильно заряженных и слабо заряженных частиц. Fr — отталкивание двойных электрических слоев; — вандерваальсово притяжение; V—результирующее взаимодействие
Эмульгаторы — поверхностно-активные вещества, способствующие образованию эмульсий
Для стабилизации эмульсий используют поверхностно-активные вещества. Для этой же цели применяют соединения других типов, например дифильные полимеры, небольшие твердые частицы и др. Поверхностно-активные вещества используют также при получении эмульсий, т. е. для тонкого диспергирования масла в воде или воды в масле. Для этого необходимо выполнение двух условий: ПАВ должно понижать межфазное натяжение до низких значений и должно быстро диффундировать к вновь возникающей межфазной поверхности. Последнее условие особенно важно; только в том случае, если новая межфазная поверхность быстро покрывается монослоем ПАВ, она будет устойчивой по отношению к коалесценции. Высокомолекулярные полимеры, гидрофобные частицы, белки в изоэлектрической точке и жидкие кристаллы способны эффективно стабилизировать межфазную границу масло-вода. Но эти крупные частицы медленно диффундируют к возникающей межфазной поверхности. Для создания эмульсий лучше использовать низкомолекулярные ПАВ. Другие упомянутые компоненты выполняют более значимую роль в стабилизации системы. Поверхностно-активные вещества, добавляемые в систему для образования эмульсий, называют «эмульгаторами».
Концепция гидрофильно-липофильного баланса
В эмульсионной технологии существует эмпирическое правило: водорастворимые эмульгаторы обычно образуют эмульсии «масло в воде», в то время как маслорастворимые эмульгаторы — эмульсии «вода в масле». Эта концепция известна как правило Банкрофта.
Правило Банкрофта сугубо качественное. Гриффин, пытаясь превратить его в некоторое количественное соотношение между гидрофильностью ПАВ и его функциями в растворе, предложил концепцию гидрофильно-липофильного баланса поверхностно-активного вещества. Числа ГЛБ для нормальных неионных ПАВ определеляются следующими простыми расчетами.
1) Для этоксилированных спиртов и этоксилированных алкилфенолов:
![]()
2) Для этоксилированных многоатомных спиртов:
![]()
3) Для сложных эфиров жирных кислот и многоатомных спиртов:
![]()
Концепция чисел ГЛБ Гриффина впоследствии была развита Дэвисом, который ввел схему, позволяющую приписывать групповые числа ГЛБ химическим группам, составляющим молекулу ПАВ. Формула Девиса и значения некоторых типичных групповых чисел приведены в табл. 1. Из этой таблицы видно, что сульфатная группа потенциально намного более полярна, чем карбоксильная, и что концевая гидроксильная группа полиоксиэтиленовой цепи более гидрофильна, нежели гидроксильная группа Сахаров.
Таблица 1. Числа ГЛБ по Дэвису

Таблица 2. Использование чисел ГЛБ Гриффина
| Диапазон чисел ГЛБ | Смешение с водой |
| 1-4 | Диспергирование не происходит |
| 3-6 | Слабое диспергирование |
| 6-8 | Молочная дисперсия после встряхивания |
| 8-10 | Устойчивая молочная дисперсия |
| 10-13 | Опалесцирующая или прозрачная система |
| 13-20 | Прозрачный раствор |
| Диапазон чисел ГЛБ | Применение |
| 3-6 | Эмульгаторы для систем «вода в масле» |
| 7-9 | Смачивающие агенты |
| 8-14 | Эмульгаторы для систем «масло в воде» |
| 9-13 | Моющие составы |
| 10-13 | Солюбилизаторы |
| 12-17 | Диспергаторы |
Концепция чисел ГЛБ, особенно в версии Гриффина, оказалась полезной при первичном отборе ПАВ для определенных целей. Таблица 2 показывает корреляцию между видом водного раствора ПАВ и ГЛБ, а также типичным применением ПАВ с данными числами ГЛБ. Эмульгатор для эмульсии «вода в масле» должен быть гидрофобным с числом ГЛБ 3-6, а эмульгатор для эмульсии «масло в воде» должен иметь числа ГЛБ в интервале 8-18. Это находится в хорошем согласии с правилом Банк-рофта.
Для комнатной температуры числа ГЛБ, рассчитанные по Гриффину или по Девису, позволяют выбрать эмульгатор, что будет показано ниже. Проблема возникает при повышении температуры в процессе эмульгирования или при хранении готовой эмульсии при низких температурах. Полиоксиэтилированные неионные ПАВ чрезвычайно чувствительны к температуре. Многие из них образуют эмульсию типа «масло в воде» при обычных температурах и типа «вода в масле» — при повышенных температурах. Такие факторы, как концентрация электролита в водной фазе, полярность масла и соотношение воды и масла, влияют на тип образующейся эмульсии. Очевидно, что числа ГЛБ невозможно использовать как универсальный способ выбора эмульгатора или определения типа эмульсии, которая образуется с данным ПАВ.
Метод ГЛБ - приближенный, но простой способ выбора эмульгатора
Эмпирически было установлено, что для получения устойчивой эмульсии комбинация ПАВ, одного более гидрофильного, а другого более гидрофобного, оказывается более эффективной, чем использование одного ПАВ с промежуточными числами ГЛБ. Вероятнее всего, комбинация ПАВ с сильно различающимися значениями КПУ обеспечивает лучшую упаковку ПАВ на межфазной поверхности по сравнению с упаковкой индивидуального ПАВ. Преимущество смеси ПАВ может быть также связано со скоростью подвода ПАВ к межфазной поверхности. В присутствии маслорастворимых и водорастворимых эмульгаторов к вновь создающейся межфазной поверхности стабилизирующие ее ПАВ подводятся одновременно с двух сторон. Независимо от механизма использование комбинации ПАВ с низкими и высокими числами ГЛБ для получения эмульсий оказывается очень эффективным и часто применяется на практике. Типичный пример такой комбинации приведен на рис. 7.
Ряд общих правил подбора ПАВ-эмульгатора можно сформулировать следующим образом.
1) Поверхностно-активное вещество должно обладать сильно выраженной склонностью мигрировать к межфазной поверхности.
2) Маслорастворимые ПАВ преимущественно образуют эмульсии «вода в масле».
3) Устойчивые эмульсии часто образуются при использовании смеси гидрофильного и гидрофобного ПАВ.
4) Чем более полярна масляная фаза, тем выше должна быть гидрофильность эмульгатора.
Числа ГЛБ приписаны различным часто эмульгируемым веществам: растительным маслам, парафинам, ксилолу и др. Эти числа получены из экспериментов по эмульгированию: вещества эмульгируются с различными гомологами неионных ПАВ и определяются значение числа ГЛБ для оптимального ПАВ. В таблице 3 приведены числа ГЛБ наиболее распространенных «масел».
В процессе эмульгирования эмульгатор или комбинация эмульгаторов должны быть выбраны с числом ГЛБ, равным числу ГЛБ фазы, которую нужно эмульгировать. При использовании смесей ПАВ ее ГЛБ определяется как средневзвешенное число из чисел ГЛБ индивидуальных ПАВ. Пример использования метода ГЛБ для выбора эмульгатора приведен на рис. 7.

Рис. 7. Пример использования метода ГЛБ для подбора эмульгатора
Несмотря на то, что метод ГЛБ полезен для предварительного выбора эмульгатора, он имеет ряд ограничений. Например, он совершенно непригоден, если при эмульгировании происходит изменение температуры. Кроме того, на эффективность такого подхода сильно влияют следующие факторы:
1) примеси в масле;
2) электролит в воде;
3) присутствие ко-ПАВ или других веществ.
Таблица 3. Числа ГЛБ для некоторых органических жидкостей
| Вещество | Число ГЛБ |
Ацетофенон Лауриновая кислота Линолевая кислота Олеиновая кислота Рицинолевая кислота Стеариновая кислота Цетиловый спирт Дециловый спирт Лауриловый спирт Тридециловый спирт Бензол Тетрахлорид углерода Касторовое масло Хлорированный парафин Циклогексан Керосин Безводный ланолин Ароматическое минеральное масло Парафиновое минеральное масло Минеральные растворители Петролатум Сосновое масло Тетрамер пропена Толуол Пчелиный воск Канделильский воск Карнаубский воск Микрокристаллический воск Парафин Ксилол | 14 16 16 17 16 17 15 14 14 14 15 16 14 8 15 14 12 12 10 14 7-8 16 14 15 9 14-15 12 10 10 14 |
Концепция температуры инверсии фаз
Физико-химические свойства неионных ПАВ с полиоксиэтиленовыми цепями сильно зависят от температуры. Одно и то же ПАВ может стабилизировать эмульсии с водой в качестве дисперсионной среды при низких температурах и с маслом в качестве дисперсионной среды при высоких температурах. Концепция, в основе которой лежит температура инверсии фаз, определила более количественный подход для оценки эмульсионных систем, стабилизированных ПАВ. Принята следующая процедура для определения ТИФ: эмульсию масла в воде, содержащей -5% неионного ПАВ, встряхивают при повышении температуры. Температуру, при которой происходит инверсия фаз и эмульсия «масло в воде» переходит в эмульсию «вода в масле» определяют как ТИФ системы. Инверсию фаз можно легко определить по резкому падению электропроводности, когда эмульсия с водной дисперсионной средой трансформируется в эмульсию с масляной дисперсионной средой.
В лабораторных условиях ТИФ определяют, как правило, используя модельные неионные ПАВ с узким гомологическим распределением. В связи с этим важно заметить, что ТИФ такого НПАВ отличается от ТИФ технических НПАВ с тем же средним числом этоксилирования. Разница особенно велика для НПАВ с относительно короткими полиоксиэтиленовыми цепями. Это объясняется тем, что в составе ПАВ с широким гомологическим распределением дифильные молекулы с короткими полиоксиэтиленовыми цепями преимущественно растворяются в масляной фазе, а фракции с длинными полиоксиэтиленовыми цепями в значительной мере растворяются в водной фазе. Обычно растворимость в масляной фазе больше, чем в водной фазе, поэтому большая доля ПАВ «потеряется» в масляной фазе, а ПАВ, адсорбированное на межфазной поверхности, окажется более гидрофильным, чем «усредненное ПАВ», введенное в систему. Следовательно, ТИФ будет выше, чем при отсутствии такого фракционирования. Распределение между водной и масляной фазами происходит и для индивидуального поверхностно-активного гомолога, но это не влияет на температуру инверсии фаз, поскольку во всех фазах — в водной, масляной и на границе раздела фаз — присутствуют одни и те же молекулы.
В то время как число ГЛБ является характеристикой свойств изолированной молекулы ПАВ, ТИФ характеризует свойства эмульсии, в которой гидрофиль-но-липофильные свойства неионного поверхностно-активного вещества, использованного в качестве эмульгатора, полностью сбалансированы. Безусловно, между ТИФ и числами ГЛБ имеется корреляция. Увеличение длины полиок-сиэтиленовой цепи в неионных поверхностно-активных веществах приводит к увеличению чисел ГЛБ и увеличению ТИФ. Другие факторы, влияющие на ТИФ, таковы.
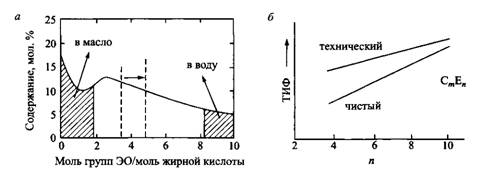
Рис. 8. Для технических этоксилированных спиртов характерна более высокая температура инверсии фаз, чем для индивидуального ПАВ с той же средней степенью этоксилирования. Разница в ТИФ связана с распределением гидрофильных и гидрофобных фракций в масле и воде соответственно. Большая доля ПАВ переходит в масло, а не в воду
1) Природа масла. Чем менее полярно масло, тем выше ТИФ. Например, у эток-силированного нонилфенола в системе бензол-вода при соотношении жидких фаз 1:1 ТИФ равна ~ 20 °С. При замене бензола на циклогексан ТИФ возрастает до 70 °С, при замене масляной фазы на гексадекан ТИФ превышает 100 °С.
2) Концентрация электролита и тип соли. ТИФ понижается при добавлении большинства солей. Замена дистиллированной воды на 5%-ный раствор хлорида натрия приводит к понижению ТИФ почти на 10 °С. Зависимость ТИФ от концентрации и типа соли аналогична зависимости, характерной для точки помутнения.
3) Добавки в масляной фазе. Добавки, приводящие к увеличению полярности масла, например жирные кислоты или спирты, заметно снижают ТИФ. Добавки, хорошо растворимые в воде, например этанол и изопропанол, оказывают на ТИФ противоположное влияние.
4) Соотношение объемов масла и воды. Можно считать, что точка инверсии фаз индивидуального НПАВ не зависит от соотношения объемов масла и воды в интервале от 0.2 до 0.8. В случае технических поверхностно-активных веществ, которые содержат гомологи с разными числами ГЛБ, соотношение объемов жидких фаз влияет на распределение компонентов смеси ПАВ между жидкими фазами, приводя к увеличению ТИФ с увеличением соотношения объемов масло/вода. Если измерить ТИФ при различных соотношениях объемов жидких фаз и экстраполировать эту зависимость к нулевому соотношению объемов масла/вода, то полученное значение в первом приближении соответствует точке помутнения поверхностно-активного вещества.
Эти эффекты находятся в полном согласии с правилом Банкрофта, т. е. с тем, что растворимость эмульгатора контролирует процесс эмульгирования. Так, добавление полярного, растворимого в масле органического компонента приводит к увеличению полярности масляной фазы, что в свою очередь приводит к увеличению растворимости в масле поверхностно-активного вещества. Правило Банкрофта утверждает, что в этих условиях преимущественно образуются эмульсии типа «вода в масле». Для получения сбалансированной системы необходимо усилить растворимость поверхностно-активного вещества в воде, что достигается понижением температуры, поскольку НПАВ, содержащие полиоксиэтилено-вые цепи, сильнее растворяются в воде при пониженных температурах. Введение добавок понижает ТИФ.
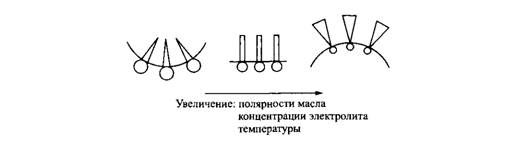
Рис. 9. Влияние полярности масла, концентрации электролита и температуры на кривизну межфазной границы масло-вода
Подбор эмульгатора методом определения ТИФ
Межфазное натяжение на поверхности масло-вода минимально при температуре инверсии фаз. Эмульсии, образующиеся при этой температуре, тонкодисперсные, но неустойчивые по отношению к коа-лесценции. Пользуясь методом определения ТИФ, для эмульгирования выбирают такой эмульгатор, который имеет точку ТИФ примерно на 40 0C выше температуры хранения готовой эмульсии, полученной при одинаковых объемах жидких фаз и 5%-ном содержании НПАВ. Эмульгирование проводят при температуре на 2-4 0C ниже ТИФ, а затем эмульсию быстро охлаждают до температуры хранения, при которой коалесценция протекает с низкой скоростью. Эффективный способ охлаждения состоит в том, что эмульгирование проводят в относительно небольшом количеством воды, а затем добавляют холодную воду.
Можно также получить эмульсию при температуре немного выше ТИФ, при этом образуется эмульсия «вода в масле». Затем добавляют холодную воду, что приводит к инверсии фаз с образованием эмульсии «масло в воде». Этот способ обычно используют при эмульгировании очень вязких масел, например алкидных и других смол, однако капли в эмульсиях при этом не такие маленькие, как при использовании метода ТИФ без инверсии фаз.
Различные типы неионных ПАВ как эмульгаторы
Традиционно в качестве эмульгаторов использовали этоксилированные алкил-фенолы. Из-за пристального внимания к вопросам биоразлагаемости и токсичности в водной среде эти НПАВ были вытеснены этоксилированными спиртами с примерно такими же числами ГЛБ. Иногда такая замена не является адекватной, что можно объяснить различием структур гидрофобных частей НПАВ этих двух типов. Гидрофобный радикал в этоксилированных спиртах обычно представлен неразветвленными углеводородными цепями алифатических углеводородов, а этоксилированные алкилфенолы содержат объемный и сильно поляризующийся гидрофобный «хвост».
Адсорбция поверхностно-активного вещества на межфазной границе определяется его молекулярной структурой. По сравнению с размером молекул ПАВ межфазную границу масло-вода на эмульсионной капле можно считать плоской. Следовательно, чтобы получить оптимальную упаковку молекул ПАВ на межфазной границе, которая контролирует устойчивость эмульсий, молекулы поверхностно-активного вещества должны иметь такую геометрию, чтобы размер полярной группы был приблизительно одинаковым с размером гидрофобного «хвоста». Другими словами, значение КПУ такого ПАВ должно быть близким к единице. Легко увидеть, например рассматривая молекулярные модели, что у линейных этоксилированных спиртов, обычно использующихся в качестве эмульгаторов при получении эмульсий «масло в воде», объем гидрофобного «хвоста» намного меньше объема полярной группы. У соответствующих этоксилированных алкилфенолов объем гидрофобных «хвостов» также меньше, чем объем полярной группы, но это различие не столь большое. Поэтому линейные этоксилированные жирные спирты хуже упаковываются на границах раздела фаз, чем этоксилированные алкилфенолы. Различие в упаковке молекул данных НПАВ на межфазных границах можно объяснить также тем, что движущая сила адсорбции таких этоксилированных спиртов меньше, чем для этоксилированных алкилфенолов.
Этоксилированные спирты, молекулы которых содержат гидрофобные разветвленные фрагменты, характеризуются более сбалансированной геометрией, чем их линейные аналоги. Так называемые «спирты Гербе» — спирты с длинными боковыми цепями у второго атома углерода, являются перспективным сырьем для получения сбалансированных этоксилированных спиртов. Было установлено, что такие НПАВ потенциально могут заменить этоксилированные алкилфенолы в разнообразных практических целях. Спирты с боковыми метальными группами, получаемые в процессе «оксосинтеза», представляют другой тип разветвленных спиртов.
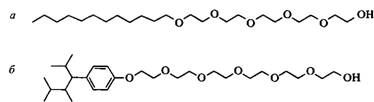
Рис. 10. Структуры нормальных этоксилированных спиртов и этоксилированного нонилфенола
Еще одно различие между этоксилированными нонилфенолами и этоксили-рованными спиртами — это наличие шести р-электронов в гидрофобной части нонилфенолов, что влияет на взаимодействия между ПАВ и ненасыщенными компонентами масла. Известно, что фенолы способны выступать донорами электронов при образовании донорно-акцепторых комплексов, предоставляя р-электроны молекулам-акцепторам электронов. Это взаимодействие может быть достаточно сильным, хотя природа связи до конца не ясна. Разумно предположить, что при взаимодействии этоксилированных алкилфенолов с двойной связью молекул, находящихся в масляной фазе, образуются такие комплексы, чего не может быть в случае этоксилированных спиртов. Образование донор-но-акцепторного комплекса с участием этоксилированного нонилфенола показано на рис. 11.
Электронные эффекты не настолько вездесущи, как эффекты геометрической упаковки. Донорно-акцепторные комплексы могут возникать только в том случае, если масло содержит компоненты, способные выступать как акцепторы электронов. Такими компонентами могут быть олефины и ароматические соединения, особенно содержащие группы, способные оттягивать электроны. Множество пищевых эмульсий, как и многие технические эмульсии, содержат масла с ненасыщенными компонентами. Образование комплексов способствует усилению взаимодействия между эмульгатором и масляной фазой. В свою очередь это позволяет использовать поверхностно-активные вещества с немного более длинными полиоксиэтиленовыми цепями, чем обычно. Более длинные оксиэти-леновые цепи обеспечивают более высокую растворимость поверхностно-активного вещества в воде. Такие ПАВ, не дающие дополнительного вклада в гидрофобные взаимодействия неполярных радикалов с маслом, преимущественно находятся в водной фазе. Использование поверхностно-активных веществ с более длинными оксиэтиленовыми цепями выгодно, поскольку такие цепи обеспечивают сильное стерическое отталкивание между каплями, предотвращая их коалесценцию.
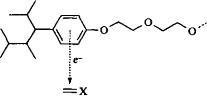
Рис. 11. Электронный донорно-акцепторный комплекс между этоксилированным нонилфенолом и ненасыщенной связью
Правило Банкрофта и динамика адсорбции ПАВ
Рис. 12 поясняет правило Банкрофта, предсказывающее тип образующейся эмульсии в присутствии конкретного ПАВ. При наложении сдвиговых напряжений на смесь масла и воды межфазная граница масло-вода расширяется с образованием «пальцев» воды в масле и масла в воде. Такая ситуация неустойчива. Если происходит разрыв «паль