Прикладные аспекты темы "Скорость химической реакции и катализ" на уроках химии в средней школе
Глава 1. Состояние изучаемого вопроса в современной российской школе
1.1. Урок № 1 «Закономерности течения химических реакций»
1.1.1. Скорость химической реакции
1.1.2. Термохимические уравнения
1.1.3. Химическое равновесие
1.2. Практическая работа «Действие катализаторов»
1.3. Практическая работа «Влияние условий на скорость химических реакций»
1.4. Практическая работа «Химическое равновесие и условия его смещения»
Глава 2. Прикладные аспекты преподавания темы «Закономерности течения химических реакций»
2.1. Вводная часть (применение и основные сведения)
2.2. Исходное сырье
2.3. Характеристика целевого продукта
2.4. Химическая схема процесса
Глава 3. Тесты и задачи прикладного характера
3.1. Тесты типа «А»
3.2. Тесты типа «В»
3.3. Тесты типа «С»
3.4. Решение производственных задач по теме «Химическое равновесие»
Заключение
Литература
В современных условиях одной из самых актуальных проблем методики преподавания химии в школе становится обеспечение практической ориентированности предметного знания. Это означает необходимость выявления тесной взаимосвязи между изучаемыми теоретическими положениями и практикой жизни, демонстрации прикладного характера химических знаний.
Для того чтобы сохранить познавательный интерес учащихся, нужно убедить их в действенности химических знаний, сформировать личную потребность в овладении учебным материалом. Этому могут способствовать специально составленные задания, которые кроме собственно контролирующих вопросов содержат информацию прикладного характера, полезную в быту. (1)
В этой связи весьма актуальным является тема данной курсовой работы – изучение прикладных аспектов темы «Скорость химической реакции и катализ» на уроках химии в средней школе.
Глава 1. Состояние изучаемого вопроса в современной российской школе
Для осознанного понимания химических процессов огромное значение имеет представление о химической кинетике и равновесии. Эти вопросы всегда были самыми сложными не только для учащихся, но и для учителей. Учебный материал темы поделен на 6 уроков, поскольку давно известно, что на одном уроке нельзя ознакомить учащихся более чем с двумя понятиями.
План изучения темы
1. Скорость химических реакций.
2. Зависимость скорости реакции от внешних факторов.
3. Влияние температуры на скорость реакции.
4. Катализ.
5-6. Химическое равновесие и его смещение.
Преподавание темы «Закономерности течения химических реакций. Скорость химической реакции и катализ» начинается с 9 класса, первого полугодия. При изучении этой темы пользуются учебником химии под редакцией Г. Е. Рудзитис, Ф.Г. Фельдман, также учебником за 8 - 9 класс под редакцией Н. С. Ахметова. Дидактическим материалом служит книга по химии для 8 - 9 классов под редакцией А. М. Радецкого, В. П. Горшкова; используются задания для самостоятельной роботы по химии за 9 класс под редакцией Р. П. Суровцева, С. В. Софронова; используется сборник задач по химии для средней школы и для поступающих в вузы под редакцией Г. П. Хомченко, И. Г. Хомченко. В 9 классе на изучение закономерностей протекания химических реакции отводится 6 ч (3, 4).
1.1 Урок № 1 «Закономерности течения химических реакций»
Знать: энергетику химических превращений; закон Гесса; зависимость скорости химической реакции от температуры, концентрации, площади соприкосновения реагирующих веществ, природы реагирующих веществ, участия катализаторов и ингибиторов; правило Вант-Гоффа; принцип Ле Шателье; условия смещения химического равновесия.
Уметь: на конкретных примерам разъяснять зависимость скорости химических реакций от различных факторов и смещение химического равновесия в зависимости от условий течения реакций; использовать понятия скорости химической реакции, теплот образования и сгорания при решении расчетных задач.
Основные понятия: тепловой эффект, термохимическое уравнение, экзотермические и эндотермические реакции, энтальпия, энергия активации, теплоты образования и сгорания веществ, энтропия, химическое равновесие, реакции обратимые и необратимые, реакции прямые и обратные, равновесные концентрации, константа химического равновесия, скорость химической реакции, катализатор, ингибитор, каталитическая реакция (2).
Контрольные вопросы
1. От каких факторов зависит скорость реакции?
2. Что называют скоростью химической реакции?
3. По каким формулам можно рассчитать величину скорости реакции?
4. Как формулируют закон действия масс?
5. Как читается правило Вант-Гоффа?
6. Почему при повышении температуры скорость реакции возрастает?
7. Какие вещества называют катализаторами, а какие ингибиторами?
8. Что называют кинетическим уравнением реакции?
9. Что называют энергией активации?
10. Какие реакции называют обратимыми и какие необратимыми?
11. Что называют химическим равновесием?
12. Что называют константой равновесия?
13. Что называют смещением химического равновесия?
14. Как читается принцип Ле Шателье?15. Почему любая химическая реакция сопровождается тепловым эффектом?
16. Какие реакции называют экзотермическими, а какие эндотермическими?
17. Сформулируйте закон Гесса и следствия из него.
1.1.1 Скорость химической реакции
Скорость химической реакции u – физическая величина.
![]()
где С1 – начальная концентрация одного из реагирующих веществ в момент времени t1, С2 – концентрация в момент времени t2, t1 – начальное время, t2 – время окончания реакции. Поскольку значение скорости реакции не может быть отрицательным, то в случае получения отрицательного значения берем его математический модуль.
Единицы измерения величин: С – моль/л, t – с (секунда), u – моль/(л•с).
Скорость химической реакции зависит: от природы реагирующих веществ; от концентрации реагентов; от температуры; от поверхности соприкосновения реагирующих веществ (для гетерогенных систем); от участия катализатора или ингибитора.
Для реакции А + В = С
u = k(A)•(B),
где k – константа скорости, (A) – концентрация вещества А, (В) – концентрация вещества В.
Если в реакции в отдельном столкновении участвуют а молекул А и b молекул В, т. е. аА + bВ = С, то выражение u = k•(A)а•(B)b называют законом действующих масс. (Показатели степени а и b часто не равны стехиометрическим коэффициентам вследствие сложного механизма реакции.)
При повышении температуры на каждые 10° скорость реакции возрастает в 2–4 раза (правило Вант-Гоффа):
![]()
где u2 – скорость реакции при температуре t2, u1 – скорость реакции при температуре t1, g – температурный коэффициент, он принимает значения от 2 до 4. Скорость реакции обратно пропорциональна времени:
![]()
Алгоритмы по теме «Скорость химической реакции»
Алгоритм 1. Вычисление скорости химической реакции.
Задача. Вычислите среднюю скорость химической реакции, если через 20 с от начала реакции концентрация веществ составляла 0,05 моль/л, а через 40 с – 0,04 моль/л.

Алгоритм 2. Зависимость скорости химической реакции от концентрации реагентов
Задача. Как изменится скорость химической реакции 2СО + О2![]() 2СО2, если уменьшить объем газовой смеси в 2 раза?
2СО2, если уменьшить объем газовой смеси в 2 раза?
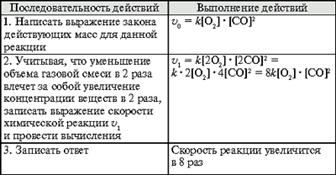
Алгоритм 3. Зависимость скорости реакции от температуры
Задача. Во сколько раз увеличится скорость химической реакции при повышении температуры от 300 до 350 °С, если температурный коэффициент равен 2?

Задачи для самоконтроля
1. Как изменится скорость реакции
2Fe + 3Cl2![]() 2FeCl3,
2FeCl3,
если давление системы увеличить в 5 раз?
Ответ. Увеличится в 125 раз.
2. Скорость реакции при охлаждении от 80 до 60 °С уменьшилась в 4 раза. Найти температурный коэффициент скорости реакции.
Ответ. 2.
3. Реакция при 50 °С протекает за 2 мин 15 с. За какое время закончится эта реакция при t = 70 °C, если температурный коэффициент равен 3?
Ответ. 15 с.
1.1.2 Термохимические уравнения
В термохимических уравнениях в отличие от химических указывается тепловой эффект химической реакции и между левой и правой частями уравнения принято ставить знак равенства (=).
Тепловой эффект Q измеряется в килоджоулях (кДж), в случае экзотермических реакций он положителен, а в случае эндотермических реакций отрицателен.
Энтальпия (DН) – величина, характеризующая внутреннюю энергию вещества, обратная по знаку тепловому эффекту, имеет размерность кДж на моль (кДж/моль).
Две возможные формы записи термохимического уравнения:
2Н2 (г.) + О2 (г.) = 2Н2О (г.) + 483,6 кДж
Н2 (г.) + 1/2О2 (г.) = Н2О (г.), ![]() = –241,8 кДж/моль.
= –241,8 кДж/моль.
Закон Гесса: тепловой эффект реакции равен разности между суммой теплот образования продуктов реакции и суммой теплот образования исходных веществ:
![]()
При химической реакции теплота выделяется или поглощается. Реакции, протекающие с выделением теплоты, называются экзотермическими реакциями, а сопровождающиеся поглощением теплоты – эндотермическими.

Эндотермические и экзотермические реакции
Алгоритм 4. Вычисление теплового эффекта реакции по известному термохимическому уравнению

Задача. По термохимическому уравнению
N2 (г.) + О2 (г.) = 2NО (г.) – 180,7 кДж
вычислите, сколько поглотится теплоты при вступлении в реакцию 5,6 л азота (н. у.).
Алгоритм 5. Составление термохимического уравнения
Задача. При сжигании 3 г магния выделилось 75,15 кДж теплоты. Составьте термохимическое уравнение реакции горения магния.
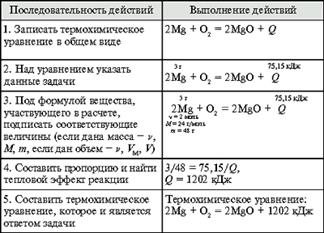
Алгоритм 6. Вычисление теплоты сгорания вещества
Задача. По термохимическому уравнению реакции
2СО (г.) + О2 (г.) = 2СО2 (г.) + 566,5 кДж
вычислите теплоту сгорания оксида углерода(II).

Алгоритм 7. Вычисление теплоты образования вещества

Задача. При сжигании 93 г белого фосфора выделилось 2322 кДж теплоты. Рассчитайте теплоту образования оксида фосфора(V).
Алгоритм 8. Вычисление теплового эффекта реакции по закону Гесса
Задача. Вычислите тепловой эффект реакции
Fe2O3 + 2Al ![]() Al2O3 + 2Fe,
Al2O3 + 2Fe,
если теплота образования оксида железа(III) составляет +821,5 кДж/моль, а теплота образования оксида алюминия +1675,7 кДж/моль (теплота образования простого вещества равна нулю).

Задания для самоконтроля
1. Составьте термохимическое уравнение реакции разложения карбоната кальция, если при разложении 40 г карбоната кальция поглощается 70,8 кДж теплоты.
Ответ. CaCO3 = CaO + CO2![]() – 177 кДж/моль.
– 177 кДж/моль.
2. Сколько теплоты выделится при полном сгорании 1 м3 смеси, состоящей из 30% (по объему) этилена и 70% ацетилена, если при сгорании 1 моль этих веществ выделяется соответственно 1400 и 1305 кДж?
Ответ. 59 531 кДж.
3. Вычислите теплоту сгорания ацетилена С2Н2, если теплота образования углекислого газа 393,5 кДж/моль, водяного пара – 242 кДж/моль, ацетилена – 226,8 кДж/моль.
Ответ. 1604,4 кДж.
Необратимых реакций нет, любой процесс, рассматриваемый как необратимый, может быть превращен в обратимый (и наоборот). Разложение карбоната кальция:
![]()
Реакция необратима, если она осуществляется в открытой системе (т. е. где из сферы реакции возможно улетучивание оксида углерода(IV)). Однако в замкнутой системе процесс идет не полностью. Когда в системе устанавливается определенное давление газа, препятствующее разложению, процесс становится обратимым. Для обратимой реакции, записываемой в общем виде:
aA + bB = cC + dD,
скорость прямой реакции uпр определяется из соотношения:
![]()
где k1 – константа скорости прямой реакции, cA и cB – молярные концентрации веществ А и В. Концентрации веществ А и В уменьшаются, и, следовательно, скорость прямой реакции понижается. Появление в системе продуктов С и D означает возможность протекания обратного процесса, скорость которого uобр математически выражается следующим образом:
![]()
По мере накопления в системе веществ С и D скорость обратного процесса непрерывно возрастает до выравнивания скоростей прямой и обратной реакций: uпр = uобр. Подобное состояние системы называется химическим равновесием. Соотношение между концентрациями при равновесии выражается формулой:

где Kp – константа равновесия, (A), (B), (C), (D) – равновесные концентрации веществ. Величина константы химического равновесия зависит от природы реагирующих веществ и от температуры. Если Kp > 1, то uпр > uобр, если Kp < 1, то uпр < uобр. Смещение равновесия в зависимости от изменения условий определяется универсальным принципом Ле Шателье: если на систему, находящуюся в состоянии химического равновесия, оказывать воздействие, выражающееся в изменении концентрации, температуры или давления, то равновесие смещается в направлении, способствующем ослаблению этого воздействия.
Пример 1. Почему лакмус (HInd) в кислой среде (избыток H3О+) – красный, а в щелочной (избыток гидратированного ОН–, рН > 7) – cиний?
Решение
Уравнение диссоциации индикатора можно представить в виде:
HInd ![]() Н+ + Ind–.
Н+ + Ind–.
В состоянии химического равновесия:
![]()
1) При избытке в растворе гидратированного Н+ (кислая среда, рН < 7) Кр < 1. Химическое равновесие сдвигается в сторону обратной реакции, т. е. в растворе накапливаются недиссоциированные молекулы индикатора красного цвета.
2) Избыток ОН– (щелочная среда, рН > 7) нейтрализует ионы гидроксония, т. е. уменьшает их концентрацию, что сдвигает равновесие вправо (Кр > 1), в сторону накапливания гидратированных анионов индикатора синего цвета Ind–.
Пример 2. Вывести математическое выражение Кр для реакции:
2SO2 + O2 = 2SO3 + Q.
Используя численное значение Кр и принцип Ле Шателье, объяснить, как можно предсказать сдвиг равновесия вправо.
Решение
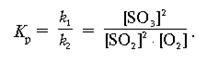
Сместить равновесие вправо можно с помощью следующих воздействий.
1) Увеличить концентрацию реагирующих веществ. Такое воздействие можно описать неравенством:
![]()
Число молекул SO2 и O2 в единице объема увеличивается, столкновения между ними становятся чаще и концентрация SO3 тоже возрастает.
2) Уменьшить концентрацию продукта реакции. При уменьшении концентрации (отводе) SO3 результат подобен предыдущему. Новые порции исходных веществ будут реагировать для компенсации удаляемого продукта.
3) Понизить температуру. Прямая реакция – экзотермическая, поэтому для сдвига равновесия вправо систему следует охлаждать. Потерянное тепло будет восполняться вследствие усиления прямой реакции. (Наоборот, повышение температуры вызовет сдвиг равновесия влево.)
4) Повысить давление. Исходные вещества – газообразные, продукт – жидкое вещество (в виде пара). Прямая реакция идет с уменьшением объема, следовательно, увеличивая давление, мы смещаем равновесие вправо, а уменьшая – влево. Если бы реакция шла без изменения объема, то изменение давления не влияло бы на равновесие.
5) Использование катализатора не вызывает смещения равновесия. Катализатор, заметно влияющий на скорость химической реакции, равно ускоряет обе реакции – прямую и обратную.
Алгоритм 9. Использование принципа Ле Шателье

Задание. При определенных условиях реакция хлороводорода с кислородом является обратимой:
4НСl (г.) + O2 (г.) ![]() 2Сl2 (г.) + Н2O (г.), DH = –116,4 кДж.
2Сl2 (г.) + Н2O (г.), DH = –116,4 кДж.
Какое влияние на равновесное состояние системы окажут:
а) увеличение давления;
б) повышение температуры;
в) увеличение концентрации кислорода;
г) введение катализатора?
Алгоритм 10. Вычисление константы равновесия реакции
Задача. Вычислите константу равновесия для реакции
СО2 + Н2![]() СО + Н2О,
СО + Н2О,
если равновесная концентрация углекислого газа равна 0,02 моль/л, водорода – 0,005 моль/л, а угарного газа и воды – по 0,01 моль/л.

Алгоритм 11. Вычисление исходных концентраций веществ
Задача. Обратимая реакция выражается уравнением
2SO2 + O2 ![]() 2SO3.
2SO3.
Известны равновесные концентрации: для оксида серы(IV) – 0,0002 моль/л, для кислорода – 0,004 моль/л, для оксида серы(VI) – 0,003 моль/л. Найдите исходные концентрации кислорода и сернистого газа.
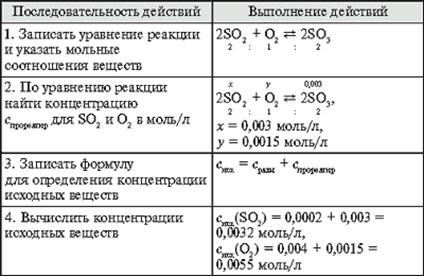
Задания для самоконтроля
1. Уравнение реакции
Н2 + I2![]() 2HI.
2HI.
Даны равновесные концентрации: водорода – 0,004 моль/л, йода – 0,25 моль/л, йодоводорода – 0,08 моль/л. Вычислить исходные концентрации водорода и йода и константу равновесия.
Ответ. (H2) = 0,044 моль/л, (I2) = 0,29 моль/л, К = 6,4.
2. Как изменится давление к моменту наступления равновесия в реакции N2 + 3Н2![]() 2NН3,протекающей в закрытом сосуде при постоянной температуре, если начальные концентрации азота и водорода равны соответственно 2 и 6 моль/л и если равновесие наступает тогда, когда прореагирует 10% первоначального количества азота?
2NН3,протекающей в закрытом сосуде при постоянной температуре, если начальные концентрации азота и водорода равны соответственно 2 и 6 моль/л и если равновесие наступает тогда, когда прореагирует 10% первоначального количества азота?
Ответ. Уменьшится в 1,05 раза.
3. В какую сторону сместится равновесие реакций:
2H2S ![]() 2Н2 + 2S – Q,
2Н2 + 2S – Q,
N2O4![]() 2NO2 – Q,
2NO2 – Q,
CO + H2O (г.) ![]() СО2 + Н2 + Q,
СО2 + Н2 + Q,
а) при понижении температуры;
б) при повышении давления?
Ответ. Смещение равновесия в реакциях:
а) при понижении температуры:
2Н2S ![]() 2Н2 + 2S – Q – влево,
2Н2 + 2S – Q – влево,
N2O4![]() 2NO2 – Q – влево,
2NO2 – Q – влево,
CO + H2O (г.) ![]() СО2 + Н2 + Q – вправо;
СО2 + Н2 + Q – вправо;
б) при повышении давления:
2Н2S ![]() 2Н2 + 2S – Q – не сместится,
2Н2 + 2S – Q – не сместится,
N2O4![]() 2NO2 – Q – влево,
2NO2 – Q – влево,
CO + H2O (г.) ![]() СО2 + Н2 + Q – не сместится (5).
СО2 + Н2 + Q – не сместится (5).
1.2 Практическая работа «Действие катализаторов»
Цели. Повторить и обобщить понятия о катализе, катализаторах, сущности их действия в определенной среде, ингибиторах и промоторах.
Оборудование и реактивы. Лучина, спиртовка, спички, шпатель, стеклянная палочка, штатив с пробирками, санитарная склянка; растворы пероксида водорода, гидроксида тетраамминмеди(II) (Сu(NH3)4)(OH)2, Na2SO3, MnCl2, CoCl2, BaCl2, соляной кислоты (разб.), оксид железа(III) Fe2O3, ацетон (диметилкетон).
Катализ – явление увеличения скорости химических реакций за счет присутствия определенных веществ (катализаторов).
Катализаторы – вещества, изменяющие скорость реакции, но сами к концу процесса остающиеся неизменными по составу и массе. Ускорение процесса – катализ. Схему катализа можно представить в таком виде:
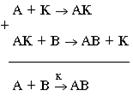
Здесь А и В – реагирующие вещества, К – катализатор, АК – промежуточное соединение, АВ – продукт реакции.
Замедление процесса – ингибирование. Существует два вида катализа – гомогенный и гетерогенный. При гомогенном катализе реагенты, продукты реакции и катализатор составляют одну фазу (газовую или жидкую), поверхность раздела отсутствует. Особый случай гомогенного катализа – автокатализ (ускорение процесса одним из продуктов реакции). Например, в кислой среде скорость реакции перманганата калия с сульфитом калия возрастает за счет образования ионов Mn2+:
![]()
Многие реакции в растворах ускоряются ионами H3O+ (pH < 7) и ОН- (pH > 7): гидролиз крахмала, омыление эфиров, гидролиз сахарозы и др. Ионы ![]() ,
, ![]() , CH3COO– также сильно ускоряют реакции органических веществ.
, CH3COO– также сильно ускоряют реакции органических веществ.
Особенность гетерогенного катализа состоит в том, что катализатор (обычно твердое вещество) находится в ином фазовом состоянии, чем реагенты и продукты. Реакция на поверхности твердого вещества идет за счет координационных связей с участием электронных пар, не участвующих в образовании связей внутри веществ. В результате внутренние связи ослабевают, и молекулы либо разрушаются, либо образуют активные радикалы.
Чем лучше адсорбируются реагенты на поверхности твердого вещества и чем слабее удерживаются продукты реакции, тем выше каталитическая активность этого вещества. Не вся поверхность гетерогенного катализатора проявляет каталитическую активность. Активные центры занимают лишь часть поверхности.
![]()
Применение каталитических методов сжигания топлива позволит в два раза поднять коэффициент его использования (сейчас 0,45) и тем самым решить вопрос обеспечения большой химии углеводородным сырьем.
| Порядок работы | Задания | Наблюдения и выводы |
| В пробирку налить 1–2 мл раствора пероксида водорода и добавить приблизительно 1 мл заранее приготовленного раствора аммиаката меди(II) | Написать уравнение реакции каталитического разложения пероксида водорода. Проверить продукты тлеющей лучинкой. Какой это вид катализа? | … |
| В две пробирки поместить оксид железа(III) объемом с горошину и прилить по 4–5 мл соляной кислоты (разб. 1:1). В одну из порций кислоты предварительно добавить 2–3 капли ацетона. Растворы перемешать стеклянной палочкой | Чем в данном процессе является диметилкетон? Какое влияние он оказывает на скорость реакции? Написать соответствующее уравнение реакции. Указать вид катализа | … |
Проверить действие катализатора на окисление сульфита натрия кислородом. В три пробирки налить по 2–3 мл разбавленного раствора Na2SO3 и в одну из них добавить 2–3 капли раствора MnCl2, в другую – раствора CoCl2. Энергично перемешать растворы и через 5–6 мин во все пробирки прилить 1–1,5 мл раствора BaCl2 | Есть ли разница в скорости реакций? Сделать выводы о действии катализаторов на реакцию 2Na2SO3 + O2 = 2Na2SO4. Составить электронный баланс процесса | Сульфит натрия широко используется как восстановитель в фотографии (для восстановления AgBr, cкрытого изображения), удаления О2 из воды на ТЭС (антикоррозионный агент), … |
1.3 Практическая работа «Влияние условий на скорость химических реакций»
Цели. Повторить понятия о скорости химических реакций и влияющих на нее факторах.
Оборудование и реактивы. Держатель для пробирок, спиртовка, спички, водяная баня, штатив с химическими пробирками, санитарная склянка; цинк (гранулы), железо (пористое восстановленное), HCl (разб., 1:2), железо (стружки), СН3СООН (разб., 1:2), H2SO4 (разб., 1:5), H2SO4 (разб., 1:10) (5).
Факторы, влияющие на скорость химических реакций
| Особенности реакций | Примеры | Теоретическое обоснование |
| Природа реагирующих веществ | Металлы (K, Na) с водой реагируют с различной скоростью | Атомы металлов K и Na отдают электроны (окисляются) с разной скоростью, т. к. RK > RNa (R – радиус атома) |
| Для гомогенных процессов скорость химической реакции зависит от концентрации реагирующих веществ | Горение вещества в чистом кислороде активнее, чем в воздухе | Частота столкновений молекул реагирующих веществ зависит от их числа в единице объема, т. е. от концентрации |
| Для веществ в твердом состоянии скорость реакции прямо пропорциональна поверхности соприкосновения реагентов | Вещества железо и сера в твердом состоянии реагируют достаточно быстро лишь в измельченном виде и при перемешивании | При измельчении и перемешивании увеличивается поверхность соприкосновения реагирующих веществ |
При повышении температуры на каждые 10° скорость реакций увеличивается в 2–4 раза (правило Вант-Гоффа): | Со многими веществами кислород начинает реагировать с заметной скоростью уже при обычной температуре (медленное окисление), а при ее повышении скорость увеличивается | Для химической реакции взаимодействующие молекулы должны быть активны (обладать достаточно энергией). При повышении температуры доля активных молекул возрастает |
Скорость химической реакции зависит от присутствия катализатора (или ингибитора): A + K AK + В
| Разложение бертолетовой соли (KClO3) и пероксида водорода (H2O2) ускоряется в присутствии МnО2. В присутствии ингибиторов соляная кислота становится инертной к металлам | В присутствии катализаторов молекулы становятся реакционноспособными при более низкой температуре. Реакционная способность KClО3 проявляется при 400 °С, а в присутствии МnO2 – при 200 °C |
В две пробирки положить по грануле цинка и прилить: в первую – 2 мл разбавленной соляной кислоты (1:2), а во вторую – 2 мл разбавленной уксусной кислоты (1:2) | Учитывая силу кислот и, следовательно, разную концентрацию ионов гидроксония (Н3О+) в их растворах, объяснить различную скорость выделения свободного водорода (Н2 | ….. |
| В одну пробирку насыпать немного порошка железа, в другую – столько же железных стружек и в обе пробирки прилить по 2 мл разбавленной соляной кислоты (1:2) | Объяснить причину большей скорости выделения пузырьков газа при взаимодействии кислоты с восстановленным железом (порошком) | ..... |
В две пробирки положить по 2 гранулы цинка: в первую – прилить 2 мл разбавленной серной кислоты (1:5), а во вторую – раствор H2SO4 (l:10) | Что наблюдается? Объяснить большую скорость взаимодействия в одном из опытов | ..... |
В две пробирки положить по 2 гранулы цинка и в обе прилить по 2 мл разбавленной серной кислоты (1:10). Одну из пробирок слегка подогреть | Сравнить результаты наблюдений, объяснить причину различной скорости химической реакции. Каким образом можно увеличить скорость реакции без нагревания? | ….. |
Подобные работы:
Применение алгоритмического метода при изучении неравенств
Применение моделирования при изучении орфографии в начальной школе
Применение проблемного обучения при изучении темы: "Предельные одноосновные кислоты"
Применение современных компьютерных технологий при изучении химии
Примерная программа по русской литературе для школ с родным (нерусским) языком обучения