Роль эндофрина в нейроэндокринной регуляции функций иммунной системы
На правах рукописи
Гейн Сергей Владимирович
РОЛЬ -ЭНДОРФИНА В НЕЙРОЭНДОКРИННОЙ РЕГУЛЯЦИИ ФУНКЦИЙ ИММУННОЙ СИСТЕМЫ
14.00.36 Аллергология и иммунология
Автореферат диссертации на соискание ученой степени доктора медицинских наук
Пермь - 2007
Работа выполнена в аналитической лаборатории Института экологии и генетики микроорганизмов УрО РАН, Пермь.
Научный консультант:
академик РАН и РАМН, д.м.н., профессор
Черешнев Валерий Александрович
Официальные оппоненты:
доктор медицинских наук, профессор Сибиряк Сергей Владимирович,
доктор медицинских наук, профессор Кузнецов Валериан Фёдорович,
доктор медицинских наук, профессор Юшков Владимир Викторович
Ведущая организация: Институт экспериментальной медицины РАМН, Санкт-Петербург.
Защита состоится «__»__________ 2007 г. в ____ часов на заседании диссертационного совета Д 004.019.01 в Институте экологии и генетики микроорганизмов УрО РАН по адресу: 614081, г. Пермь, ул. Голева, 13. Факс (342)2446711.
С диссертацией можно ознакомиться в библиотеке Института экологии и генетики микроорганизмов УрО РАН, Пермь.
Автореферат разослан «___» _______________2007 г.
Ученый секретарь диссертационного совета,
чл.-корр.РАН Ившина Ирина Борисовна
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Поддержание внутреннего гомеостаза определяется взаимодействием нервной, эндокринной и иммунной систем организма. Известно, что иммунная система многокомпонентна, ее функционирование обеспечивается сложной сетью взаимосвязанных сигналов. Одними из важнейших посредников во взаимодействии нервной и иммунной систем выступают эндогенные опиоидные пептиды, представляющие собой группу факторов и играющих ключевую роль в процессах адаптации организма (Корнева, Шхинек, 1988; Зозуля, Пшеничкин, 1990; Корнева, 2007; Maier, 2003; Pruett, 2003; Bodnar, Klein, 2006; Sharp, 2006; Wilbert-Lampen et al., 2007). Несмотря на то, что в последние годы изучению влияния эндогенных опиоидных пептидов на процессы регуляции иммунитета в литературе уделяется достаточно много внимания (Panerai, Sacerdote, 1997; Tomassini et al., 2003, 2004; Sacerdote, 2003), вопрос о механизмах реализации эффектов биорегуляторных пептидов данного класса остается крайне актуальным.
Основной источник опиоидных пептидов в организме - центральная нервная система. Основная группа пептидных гормонов (адренокортикотропный гормон, b-липотропин, меланоцитстимулирующий гормон, b-эндорфин) образуется в результате расщепления большой молекулы – предшественника проопиомеланокортина. При этом наиболее активным и полифункциональным представителем пептидов группы проопиомеланокортина является b-эндорфин. Основной источник b-эндорфина в центральной нервной системе – аркуатное ядро гипоталамуса, на периферии – промежуточная доля гипофиза, из которой пептид секретируется в кровь при стрессе, шоке, травмах и физических нагрузках. b-эндорфин является ключевым фактором, осуществляющим контроль стрессиндуцированных изменений иммунитета со стороны эндогенной опиоидной системы (Зозуля, Пшеничкин, 1990; Pedersen, Hoffman-Goetz, 2000). Роль других соединений из семейства эндогенных опиоидных пептидов, в частности энкефалинов, при стрессе значительно более скромна, а по мнению отдельных авторов (Owens, 1987) вообще отрицается.
Известно (Panerai, Sacerdote, 1997), что изменение концентрации b-эндорфина в головном, спинном мозге и гипофизе часто сочетается с неврологическими и аутоиммунными нарушениями (мигрень, рассеянный склероз, болезнь Крона). Важную роль b-эндорфин играет в патогенезе инфекционных заболеваний, модулируя функции клеток адаптивного и естественного звеньев иммунной системы при их контакте с микроорганизмами и вирусами (Ляшев, 2000; Plotnikoff, 1999; Sitte et al., 2007). В связи с этим изучение роли b-эндорфина в регуляции иммуногенеза представляет большой интерес.
Широкий спектр биологической активности b-эндорфина определяется его способностью взаимодействовать с различными по своей природе сайтами связывания, к которым относятся опиоидные (налоксон-чувствительные) и неопиоидные (налоксон-нечувствительные) рецепторы. Экспрессия опиатных рецепторов трёх основных классов (µ, d, k) и неопиоидного рецептора на клетках различных органов и тканей, в том числе и клетках иммунной системы, доказана методами радиолигандного связывания и детекции соответствующей РНК (Наволоцкая и др., 2004; Madden, 1995; Plotnikoff, 1999; Bidlack, 2000; Kraus et al., 2006; Lotsch et al., 2006; Sharp, 2006). Подобное распределение участков связывания b-эндорфина объясняет широкий спектр активности данного пептида и указывает на возможность как прямого, так и опосредованного влияния на формирование иммунного ответа (Зозуля, Пшеничкин 1990; Bidlack, 2000; Stanojević et al., 2006).
Нерешенными остаются вопросы, касающиеся изучения роли эндогенной опиоидной системы в стрессиндуцированных изменениях гуморального и клеточноопосредованного иммунитета; различных рецепторов в регуляции выраженности иммунных процессов, индуцируемых эндогенными опиоидами при стрессе, а также на фоне введения двух основных стрессреализующих факторов – глюкокортикоидов и катехоламинов. Малоизученными остаются молекулярные и клеточные механизмы иммунорегуляторного действия b-эндорфина, связанные с эффектами данного гормона на процессы пролиферации, кооперации и дифференцировки клеток иммунной системы, продукцию ряда ключевых цитокинов (g-IFN, IL-4, IL-10, IL-12), являющихся маркерными для регуляторных Т-лимфоцитов 1 и 2 типа (Th1/Th2) и определяющих выбор типа иммунного ответа. В литературе имеются довольно противоречивые данные о влиянии b-эндорфина на функции клеток естественного иммунного ответа (Van den Bergh et al., 1994; Peterson et al., 1998; Voccarino, Kastin, 2000; Sacerdote, 2003; Bodnar, Klein, 2006).
Цель настоящей работы – изучение роли опиатергических механизмов в нейроэндокринной регуляции иммуногенеза с оценкой эффектов b-эндорфина на процессы пролиферации, дифференцировки и кооперации клеток иммунной системы.
Основные задачи исследования
1. Изучить роль основных компонентов эндогенной опиоидной системы в регуляции процессов иммуногенеза в условиях острого стресса.
2. Исследовать возможность опосредованности иммунорегуляторных эффектов глюкокортикоидов и катехоламинов через взаимодействие с эндогенной опиоидной системой.
3. Оценить влияние b-эндорфина на функции клеток адаптивного иммунитета и исследовать механизм действия пептида на процессы пролиферации, кооперации и Th1/Th2-дифференцировки лимфоцитов.
4. Изучить роль b-эндорфина в регуляции функций клеток естественного иммунитета.
Научная новизна работы. Экспериментально обоснована интегральная роль эндогенной опиоидной системы в нейроэндокринной регуляции иммуногенеза в норме, в условиях стрессорного воздействии и при введении стрессреализующих гормонов – глюкокортикоидов и катехоламинов. Впервые изучено влияние b-эндорфина на процессы активации, пролиферации, кооперации и Th1/Th2-дифференцировки Т-лимфоцитов с оценкой роли различных клеточных фракций. Выявлен характер участия опиатных рецепторов различных типов в регуляции иммунных реакций под воздействием b-эндорфина и синтетических лигандов опиатных рецепоров пептидной природы. В экспериментах in vivo и in vitro подтверждено, что основной мишенью b-эндорфина является гуморальное звено иммунного ответа, при этом выявлена зависимость эффектов b-эндорфина от фазы развития иммунной реакции. В модели пролиферативного ответа лимфоцитов обнаружена зависимость эффекта b-эндорфина и селективных агонистов m- и d-рецепторов от концентрации митогена и концентрации исследуемых пептидов. Выявлена ключевая роль d-рецепторов в реализации стимулирующего эффекта b-эндорфина на пролиферацию и продукцию IL-4. Впервые установлена зависимость стимулирующего эффекта опиоидных пептидов на пролиферацию лимфоцитов и продукцию IL-4 от присутствия моноцитов в клеточной культуре. Обнаружено, что b-эндорфин снижает степень выраженности реакции бласттрансформации лимфоцитов при удалении моноцитов из клеточной культуры. Показано, что b-эндорфин стимулирует фагоцитарную активность эффекторов естественного иммунитета и оказывает модулирующее влияние на цитокинпродуцирующую функцию моноцитов и нейтрофилов. Изучен характер участия опиатных рецепторов в регуляции этих процессов.
Теоретическая и практическая значимость. Полученные данные расширяют представление о роли b-эндорфина и опиатных рецепторов разных типов в регуляции иммуногенеза. Обосновано, что формирование иммунного ответа в норме и при стрессе, а также регуляция адаптивного и естественного иммунного ответа реализуется за счёт механизмов, связанных с синтезом опиоидных пептидов. Выявлен механизм влияния опиоидных пептидов на процессы Th1/Th2-дифференцировки Т-лимфоцитов. Полученные экспериментальные данные подтверждают целесообразность использования иммуномодулирующих свойств b-эндорфина в терапии ряда аутоиммунных заболеваний (рассеянный склероз, болезнь Крона и пр.). В связи с широким использованием агонистов опиатных рецепторов в практической медицине, необходим учет последствий их применения. Результаты работы используются в лекционном курсе «Экспериментальная иммунопатология и иммунотерапия» на кафедре микробиологии и иммунологии Пермского государственного университета (614990, Пермь, Букирева 15).
Основные положения, выносимые на защиту
1. В условиях блокады опиатных рецепторов выявляется выраженная модификация иммунорегуляторных эффектов ротационного стресса, глюкокортикоидов и катехоламинов.
2. b-эндорфин в высоких дозах угнетает, в низких - стимулирует гуморальное звено иммунитета, и при этом не влияет на выраженность реакции гиперчувствительности замедленного типа. В клеточных культурах b-эндорфин стимулирует пролиферацию лимфоцитов и продукцию IL-4, не влияет на синтез IL-2 и IFN-g, при этом усиливает степень поляризации Т-хелперов в направлении Th2-клеток. В реализации стимулирующих эффектов b-эндорфина на пролиферацию и продукцию IL-4 доминирующая роль принадлежит d-рецепторам.
3. Клетки моноцитарно-макрофагального ряда играют важную регуляторную роль в направленности эффектов b-эндорфина в отношении функциональной активности CD4+ лимфоцитов.
4. b-эндорфин стимулирует фагоцитарную активность эффекторов естественного иммунитета и оказывает модулирующее влияние на цитокинпродуцирующую функцию моноцитов и нейтрофилов.
Связь работы с крупными программами. Работа проводилась в течение 2000-2007 гг. в соответствии с планом НИР ИЭГМ УрО РАН (номер госрегистрации темы НИР 01.9.009927); в рамках Программы фундаментальных исследований Президиума РАН «Молекулярная и клеточная биология»; гранта РФФИ № 06-04-49001, а также грантов молодых учёных Президиума УрО РАН 2003, 2005 гг.
Апробация работы. Материалы диссертации доложены и обсуждены на Международном симпозиуме «Взаимодействие нервной и иммунной систем в норме и патологии», Санкт-Петербург, 2007; V-VIII конференциях с международным участием «Дни иммунологии в Санкт-Петербурге», Санкт-Петербург, 2001-2007; ХIХ Российском съезде физиологического общества им. И.П. Павлова с международным участием, Екатеринбург, 2004; VI Международной конференции «Проблемы загрязнения окружающей среды», Пермь-Казань, 2005; III съезде Российского научного общества иммунологов, Екатеринбург, 2004; I-V конференциях иммунологов Урала, Екатеринбург, 2001; Пермь, 2002; Челябинск, 2003; Уфа, 2005; Оренбург, 2006; I-II конференциях молодых учёных «Современные проблемы микробиологии, иммунологии и экологии», Пермь, 1999, 2002.
Публикации. Материалы диссертационной работы обобщены в 46 печатных работах, в том числе 15 экспериментальных статьях и 31 материалах конференций.
Объем и структура работы. Диссертация изложена на 251 странице, содержит 35 таблиц, 49 рисунков и состоит из введения, литературного обзора, описания объектов и методов исследования, 5 глав результатов собственных исследований, обсуждения, выводов, списка цитируемой литературы, включающего 448 наименований, в том числе 124 на русском и 324 на английском языках.
Место проведения работы. Работа является частью исследований, выполняемых в аналитической лаборатории ИЭГМ УрО РАН (зав. – к.г.-м.н. М.А. Шишкин) совместно с лабораторией экологической иммунологии (зав. – к.м.н. Б.А. Бахметьев) по изучению механизмов иммуномодулирующих эффектов гормонов, продукция которых изменяется на фоне экологического воздействия. Исследования по проблеме нейроэндокринной регуляции иммуногенеза были инициированы профессором, заслуженным деятелем науки РФ Н.Н. Кеворковым. Научные положения диссертации и выводы, вытекающие из анализа полученного экспериментального материала, базируются на результатах собственных исследований автора.
Автор выражает искреннюю благодарность М.А. Шишкину, к.х.н. С.П. Тендряковой, профессору М.В. Черешневой, за внимание и моральную поддержку. Автор особо признателен сотрудникам группы радиоизотопных исследований к.б.н. Т.А. Баевой, инженеру Е.Г. Чижовой, магистрантам кафедры микробиологии и иммунологии Пермского государственного университета К.Г. Горшковой и И.Л. Шаравьёвой, способствующим завершению настоящей работы и чей вклад в определённые разделы исследований отражён в приведённых в списке литературы публикациях. Автор благодарит главного специалиста Муниципального управления здравоохранением Ростехнадзора, к.м.н. В.Г. Рыжаенкова за помощь в проведении иммуноферментного анализа.
Глубокую благодарность и признательность автор выражает своим учителям и наставникам академику РАН и РАМН В.А. Черешневу и доценту Ю.И. Шилову, оказавшим большое влияние на выбор целей научного поиска и формирование научного мировоззрения автора.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования. В работе использовали белых беспородных мышей массой 20-22 г и лейкоциты периферической венозной крови, полученной от здоровых людей – добровольцев мужского пола в возрасте 19-35 лет.
Для экспериментального моделирования реакции стресс использовали ротационную модель. Ротация мышей производилась в течение 60 мин по 10 мин с перерывами по 5 мин при 78 об/мин. Роль опиатных рецепторов в постстрессорных изменениях иммунных реакций исследовали путем их блокады налоксоном гидрохлоридом и налтриндолом гидрохлоридом. Налоксона гидрохлорид (DuPont, США) в разовой дозе 0,2 мг/кг массы тела и селективный антагонист d-опиатных рецепторов налтриндола гидрохлорид (ICN, США) в дозе 0,1 мг/кг вводили животным подкожно однократно за 20 мин до ротации (Ашмарин, 1988; Михайлова и др., 1992; Croock et al., 1992). В дальнейших экспериментах в системе in vivo дозы опиатных антогонистов не изменялись. Иммунизацию животных производили через 1 ч после окончания ротации.
При исследовании иммунорегуляторных эффектов опиоидных пептидов in vivo β-эндорфин (Sigma, США) в диапазоне доз от 100 мкг/кг до 0,0005 мкг/кг вводили однократно внутрибрюшинно в объеме 0,2 мл. Контролем для животных, получавших β-эндорфин, служили мыши, которым вводили по той же схеме 0,9% NaCl. μ-агонист DAGO ((d-Ala2,N-Me-Phe4,Gly5-ol)-энкефалин и δ-агонист DADLE ((d–Ala2,d-Leu5) - энкефалин) (Sigma, США) в диапазоне 10 – 0,0001 мкг/кг вводили по схеме аналогичной введению β-эндорфина. Иммунизацию животных производили через 1 ч после введения опиоидных пептидов.
Гидрокортизона ацетат (Гедеон Рихтер, Венгрия) в дозе 50 мг/кг массы тела вводили однократно внутрибрюшинно. Адреналина гидрохлорид (Московский эндокринный завод, Россия) вводили подкожно однократно в дозе 1 мг/кг. Налоксон и селективный антагонист d-опиатных рецепторов налтриндол вводили подкожно за 20 мин до введения гормонов (3 инъекции через 2,5 ч в группе с гидрокортизоном и 1 инъекция в группе с адреналином). Контролем служили интактные мыши, подвергшиеся иммунизации, но не получавшие препаратов. Дополнительным контролем для животных, получавших гидрокортизон и опиоидные пептиды, служили мыши, получавшие по той же схеме изотонический раствор хлорида натрия. Иммунизацию опытных и контрольных мышей проводили одномоментно через 3 ч от начала эксперимента в группах с гидрокортизоном, через 30 мин - в группах с адреналином.
Для моделирования локального иммунного ответа животных иммунизировали эритроцитами барана (108 клеток вводили подкожно в подошвенную поверхность правой стопы). На 4-е сутки вводили разрешающую дозу антигена (108 клеток). На 5-е сутки оценивали выраженность иммунного воспаления при реакции ГЗТ путём регистрации толщины (инженерным микрометром) и массы (на торсионных весах) опытной и контрольной стопы; количество ядросодержащих клеток (ЯСК); интенсивность антителогенеза методом локального гемолиза в геле агарозы (Jerne, Nordin, 1963). Оценку фагоцитарной активности клеток периферической крови, селезенки, регионарного и отдаленного подколенных лимфатических узлов проводили методом В.Н. Каплина с соавт. (Каплин, 1992, 1996) в модификации (Шилов и др., 1997, 1998).
Нефракционированную клеточную взвесь получали путём отстаивания верхнего слоя плазмы крови с лейкоцитами. Выделение фракции мононуклеаров и нейтрофилов проводили на градиенте плотности фиколл-верографин. Разделение моноцитов и лимфоцитов проводили методом адгезии на чашках Петри. CD4+ Т-клетки выделяли при помощи набора магнитных бус Dynabeads M-450 CD4 (Invitrogen, США). Культивирование клеток проводили в течение 24, 48 и 72 ч в пластиковых 24 и 96-луночных планшетах (Orange Scientific, Бельгия) в соответствии с традиционными методиками с использованием полной питательной среды, приготовленной на основе RPMI 1640 или среды 199 (Биолот, Россия) с добавлением 10 mM HEPES, 2 mM L-глутамина (Sigma, США), 100 мкг/мл гентамицина и 10% эмбриональной телячьей сыворотки (Биолот, Россия) или аутоплазмы во влажной атмосфере с 5% СО2 при 370С.
Пролиферативную активность оценивали по включению 3H-метилтимидина. Радиоактивность проб определяли на жидкостном сцинтилляционном счетчике Guardian (Wallac, Финляндия). Для определения концентрации IL-1β, TNF-a, IL-6, IL-8, IL-1ra, IL-2, IL-4 и IFN-γ в супернатантах культур клеток использовали спектрофотометр Униплан (Пикон, Россия) и иммуноферментные тест-системы производства ООО Протеиновый контур, ООО Цитокин, Санкт-Петербург, Вектор-Бест, Новосибирск. В экспериментах in vitro использовали агонист δ,μ-опиатных рецепторов β-эндорфин в концентрациях 10-7-10-12М; меланотропин потенцирующий фактор (MPF) - фрагмент 88-91 β-липотропина (Lys-Lys-Gly-Glu) в концентрациях 10-7-10-12М; μ-агонист опиатных рецепторов DAGO ((d-Ala2,N-Me-Phe4,Gly5-ol)-энкефалин) в концентрациях 10-7– 10-12М; δ-агонист опиатных рецепторов DADLE ((d–Ala2,d-Leu5)-энкефалин) в концентрациях 10-7–10-12М; неселективный антагонист опиатных рецепторов налоксона гидрохлорид и селективный антагонист δ-рецепторов налтриндола гидрохлорид в концентрациях 10-6, 10-8, 10-10М; липополисахарид (ЛПС) Escherichia coli O26:B6 - 0,1 мкг/мл (Sigma, США), фитогемагглютинин (ФГА) – 1,25; 2,5; 5,0; 10,0; 20,0 мкг/мл (Sigma, США), диклофенак натрия (ДН) 25 мкг/мл, моноклональные анти-IL-1b антитела – 2 мкг/мл.
Полученные данные обрабатывали с помощью многофакторного дисперсионного анализа для парных данных и корреляционного анализа. Достоверность различий между группами оценивали с помощью t-критерия Стьюдента и критерия Фишера наименьшей значимой разницы. Сортировку и обработку данных проводили на компьютере IBM PC c использованием программ Statistica for Windows 6.0 (Statsoft, Inc., США) и DIASTA (Московский государственный университет, Россия).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
Влияние ротационного стресса на показатели иммунитета. Роль опиатных рецепторов. В большинстве опубликованных работ, посвященных изучению влияния стресса на иммунный ответ, исследуются изменения системного иммунного ответа в условиях внутривенной или внутрибрюшинной иммунизации. Принимая во внимание разные компоненты внутрисистемной регуляции общих и локальных форм иммунного ответа, представлялось целесообразным исследование эффектов стресса и блокады опиатных рецепторов в условиях развития локальной формы иммунного ответа.
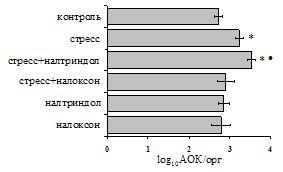
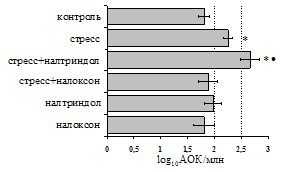
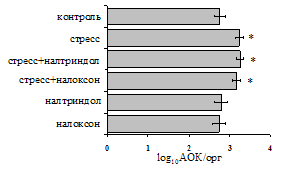
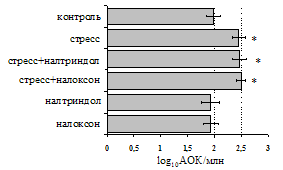
Как видно из рис. 1, в индуктивную фазу иммунного ответа на фоне стресса наблюдается увеличение числа АОК в лимфатическом узле (ЛУ) и усиление степени выраженности реакции ГЗТ. Блокада δ-опиатных рецепторов приводит к ещё более выраженной активации антителогенеза, в то время как
А Б
В Г
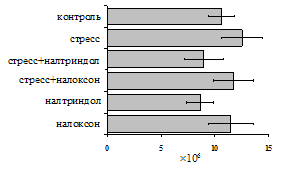
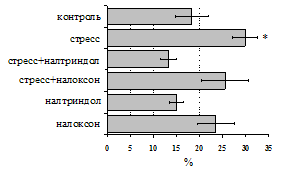
Рис. 1. Влияние ротационного стресса в условиях блокады опиатных рецепторов на абсолютное (А) и относительное (Б) число АОК, количество ЯСК в регионарном лимфатическом узле (В) и выраженность реакции ГЗТ (Г) в индуктивную фазу иммунного ответа. Здесь и на рис. 2: * - p<0,05 к контролю; • - p<0,05 к стрессу.
на фоне налоксона стимулирующий эффект ротационного стресса на антителогенез отменяется. Стрессиндуцированное усиление выраженности реакции ГЗТ отменяется как налоксоном, так и налтриндолом. Изолированное введение животным налтриндола или налоксона на количество АОК и степень выраженности ГЗТ влияния не оказывает. В эффекторную фазу иммунного ответа ротационный стресс (рис. 2) стимулирует как клеточный, так и гуморальный ответ, однако, в отличие от индуктивной фазы, на фоне блокады опиатных рецепторов эффекты стресса не модифицируются. Таким образом, стимуляция опиатных рецепторов в индуктивную фазу иммунного ответа играет важную роль в стрессиндуцированных изменениях иммуногенеза и ответственна за активацию функций иммунной системы при стрессе.
Влияние гидрокортизона и адреналина на локальный иммунный ответ в условиях блокады опиатных рецепторов. В процессе развития стрессреакции основные стрессреализующие факторы глюкокортикоиды,
А Б
В Г
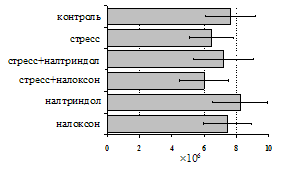
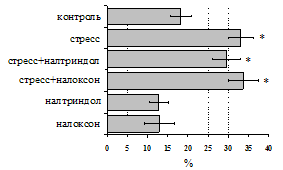
Рис. 2. Влияние ротационного стресса в условиях блокады опиатных рецепторов на абсолютное (А) и относительное (Б) число АОК, количество ЯСК в регионарном лимфатическом узле (В) и выраженность реакции ГЗТ (Г) в эффекторную фазу иммунного ответа.
Таблица 1. Влияние гидрокортизона в условиях блокады m- и d-опиатных рецепторов на число АОК, количество ЯСК в лимфатическом узле и выраженность реакции ГЗТ в индуктивную фазу иммунного ответа
| Экспериментальное воздействие | Лимфатический узел | ||
ЯСК на орган(´106) | log10 АОК на 106 ЯСК | log10 АОК на орган | |
| Интактные животные (контроль), n=19 | 8,93±1,35 | 2,15±0,15 | 3,01±0,17 |
| (142) | (1014) | ||
| Физиологический | 7,79±1,08 | 2,27±0,16 | 3,10±0,13 |
| раствор, n=16 | (186) | (1252) | |
| Гидрокортизон, n=19 | 4,98±0,68*# | 1,64±0,23 | 2,17±0,25*# |
| (43) | (149) | ||
| Гидрокортизон | 6,71±0,75a | 0,96±0,21*#a | 1,50±0,31*# |
| +Налоксон, n=15 | (9) | (32) | |
| Гидрокортизон | 5,87±0,71 | 0,55±0,14*#a | 1,07±0,22*#a |
| +налтриндол, n=17 | (4) | (12) | |
| Налоксон, n=10 | 7,76±1,27 | 2,24±0,08 | 3,07±0,14 |
| (173) | (1187) | ||
| Налтриндол, n=12 | 8,38±1,37 | 1,93±0,11 | 2,79±0,11 |
| (86) | (622) | ||
Примечание. Здесь и в табл. 2, 3, 4 в скобках указана средняя геометрическая числа АОК (антилогарифм из средней арифметической log10 числа АОК). * - p<0,05 к контролю; # - p<0,05 к физиологическому раствору; а - p<0,05 к гидрокортизону по непарному t-критерию Стъюдента..
катехоламины и эндогенные опиоиды находятся в тесной взаимосвязи и оказывают друг на друга взаимное регуляторное влияние (O`Connor, 2000). Как видно из табл. 1, в индуктивную фазу иммунного ответа гидрокортизон снижает количество ядросодержащих клеток в лимфатическом узле и абсолютное число АОК. При введении гидрокортизона на фоне блокады опиатных рецепторов налоксоном и налтриндолом регистрируется отмена индуцированного гидрокортизоном снижения количества ЯСК и ещё более выраженное угнетение антителогенеза по абсолютным и относительным показателям,
Таблица 2. Влияние адреналина в условиях блокады m- и d-опиатных рецепторов на число АОК, количество ЯСК в лимфатическом узле и выраженность реакции ГЗТ в индуктивную фазу иммунного ответа
| Экспериментальное воздействие | Лимфатический узел | |||
ЯСК наорган (´106) | log10 АОК на 106 ЯСК | log10 АОК на орган | ||
Интактные животные (контроль) n=11 | 6,29±1,04 | 2,43±0,16 | 3,15±0,22 | |
| (268) | (1403) | |||
| Адреналин, n=9 | 5,71±0,74 | 2,07±0,14 | 2,79±0,16 | |
| (118) | (618) | |||
Адреналин | 7,37±2,08 | 1,94±0,15* | 2,73±0,24 | |
| +Налоксон, n=6 | (86) | (541) | ||
| Адреналин | 6,62±1,30 | 1,78±0,25* | 2,45±0,32 | |
| +налтриндол, n=11 | (60) | (283) | ||
| Налоксон, n=10 | 7,76±1,27 | 2,24±0,08 | 3,07±0,14 | |
| (173) | (1187) | |||
| Налтриндол, n=9 | 8,07±1,82 | 2,08±1,97 | 2,90±0,13 | |
| (121) | (803) | |||
особенно ярко проявляющееся в условиях блокады d-рецепторов. Изолированное введение экспериментальным животным налтриндола и налоксона на исследуемые показатели влияния не оказывает. В эффекторную фазу иммунного ответа гидрокортизон угнетает количество ядросодержащих клеток в лимфатическом узле, абсолютное число АОК, однако в отличие от индуктивного периода на фоне блокады опиатных рецепторов эффекты гидрокортизона на показатели клеточности и антителогенеза не модифицируются.
Несколько иная картина наблюдается при анализе эффектов адреналина. Как видно из табл. 2, в индуктивную фазу адреналин оказывает статистически достоверный эффект на антителогенез по относительным показателям (F=5,28; p<0,03), несмотря на то, что при межгрупповом сравнении по отношению к контролю угнетение относительного количества АОК имеет место только при комбинации адреналина с опиатными
Таблица 3. Влияние β-эндорфина на число АОК, клеточность и выраженность реакции ГЗТ в регионарном лимфатическом узле
| Экспериментальное воздействие (β-эндорфин) | Число живот-ных | Лимфатический узел | Интенсив-ность ГЗТ | ||
ЯСК на орган (*106) | Log10 АОК на 106 ЯСК | Log10 АОК на Орган | ИР по массе стопы, % · | ||
| Контроль | 9 | 4,62±0,89 | 2,43±0,10 | 3,04±0,01 | 17,22±2,41 |
| (271,28) | (1088,94) | ||||
| 100 мкг/кг | 9 | 4,33±0,71 | 1,98±0,22* | 2,57±0,26* | 19,84±3,68 |
| (95,28) | (370,54) | ||||
| 10 мкг/кг | 8 | 5,25±0,70 | 2,06±0,26 | 2,76±0,25 | 23,92±3,46 |
| (115,56) | (569,35) | ||||
| 1 мкг/кг | 9 | 4,87±1,06 | 2,46±0,18 | 3,05±0,16 | 20,25±4,25 |
| (286,09) | (1128,59) | ||||
| 0,1 мкг/кг | 8 | 7,55±1,35 | 2,25±0,18 | 3,08±0,13 | 18,82±6,17 |
| (117,27) | (1198,91) | ||||
| 0,01 мкг/кг | 9 | 5,33±1,13 | 2,68±0,09 | 3,34±0,13 | 26,72±3,88 |
| (474,99) | (2192,95) | ||||
| 0,001 мкг/кг | 8 | 5,90±1,73 | 2,62±0,73 | 3,21±0,13 | 21,27±4,88 |
| (421,49) | (1607,54) | ||||
| 0,0005 мкг/кг | 9 | 5,82±0,81 | 2,87±0,08* | 3,61±0,07* | 28,72±4,10 |
| (743,72) | (4031,74) | ||||
Примечание. Здесь и в табл. 4: · - индекс реакции (ИР): И.Р. = (Ро–Рк)/Рк·100%, где Ро и Рк - показатели массы в опытной и контрольной конечностях. * - p<0,05 к контролю по t-критерию Фишера наименьшей значимой разницы.
антагонистами. В эффекторную фазу иммунного ответа адреналин на антителогенез в лимфатическом узле не влияет. Таким образом, блокада опиатных рецепторов в индуктивную фазу иммунного ответа приводит к существенной модификации иммунорегуляторных эффектов глюкокортикоидов и катехоламинов, связанной с изменениями секреции β-эндорфина в ответ на введение гидрокортизона или адреналина (Mougey et al., 1986; Bagdy et al., 1989; Goodwin et al., 1992).
Влияние β-эндорфина на показатели клеточного и гуморального иммунитета. Степень выраженности эффектов β-эндорфина в системе in vivo
Таблица 4. Влияние β-эндорфина в условиях блокады опиатных рецепторов на число АОК, клеточность и выраженность реакции ГЗТ в регионарном лимфатическом узле в индуктивную фазу иммунного ответа
| Экспериментальное воздействие | Чис-ло жи-во-тных | Лимфатический узел | Интенсив-ность ГЗТ | ||
ЯСК на орган (´106) | log10 АОК на 106 ЯСК | log10 АОК на орган | ИР по массе стопы, % | ||
| Контроль | 18 | 5,34±0,62 | 2,35±0,10 | 3,02±0,11 | 22,43±3,19 |
| (223,55) | (1043,31) | ||||
| β-эндорфин | 18 | 4,71±0,51 | 1,99±0,14* | 2,36±0,15* | 22,16±2,73 |
| (100 мкг/кг) | (98,80) | (423,03) | |||
| β-эндорфин | 17 | 5,98±0,66 | 2,67±0,07* | 3,40±0,08* | 27,95±2,73 |
| (0,0005 мкг/кг) | (465,21) | (2519,33) | |||
| β-эндорфин | 11 | 5,64±0,97 | 2,21±0,14 | 2,87±0,18 | 23,79±4,27 |
| (100 мкг/кг) + | (161,61) | (747,62) | |||
| налоксон | |||||
| β-эндорфин | 12 | 5,95±0,66 | 2,16±0,12 | 2,90±0,14 | 28,57±6,77 |
| (0,0005 мкг/кг) + | (143,12) | (798,77) | |||
| налоксон | |||||
| β-эндорфин | 11 | 7,18±41,24 | 2,50±0,07 | 3,29±0,05* | 23,32±4,17 |
| (100 мкг/кг) + | (314,71) | (1945,42) | |||
| налтриндол | |||||
| β-эндорфин | 11 | 9,07±1,24* | 2,52±0,09 | 3,43±0,12* | 25,67±3,12 |
| (0,0005 мкг/кг) + | (327,67) | (2673,98) | |||
| налтриндол | |||||
| Налоксон | 12 | 6,40±0,73 | 2,23±0,09 | 3,01±0,11 | 16,08±2,02 |
| (170,40) | (1013,98) | ||||
| Налтриндол | 8 | 6,98±0,55 | 2,04±0,24 | 2,87±0,21 | 18,36±1,92 |
| (110,87) | (755,38) | ||||
Примечание. * - p<0,05 к контролю по непарному t-критерию Стьюдента.
напрямую зависит от вводимой дозы пептида (табл. 3). Пептид оказывает разнонаправленный эффект на гуморальный иммунный ответ, угнетающий в дозе 100 мкг/кг и стимулирующий в дозе 0,0005 мкг/кг образование АОК в регионарном ЛУ. При этом статистически достоверного влияния β-эндорфина на клеточность ЛУ и степень выраженности реакции ГЗТ не обнаруживается. Таким образом, β-эндорфин в системе in vivo в зависимости от дозы как усиливает, так и угнетает образование антителопродуцентов.
Данные о влиянии β-эндорфина на фоне блокады опиатных рецепторов представлены в табл. 4. Блокада рецепторов неселективным антагонистом налоксоном отменяет как угнетающий эффект дозы 100 мкг/кг,