Окиснювальне старіння пива та його стабілізація
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
ДОНЕЦЬКИЙ НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ
ХІМІЧНИЙ ФАКУЛЬТЕТ
МАГІСТЕРСЬКА РОБОТА
на тему: Окиснювальне старіння пива та його стабілізація
Магістр: Левада Юрий Петрович
Спеціальність: 8.07301 “Хімія”
Керівник: к.х.н., доцент
Юраева Тетяна Анатоліївна
Донецьк-2005
Зміст
Вступ
1. Теоретична частина
1.1 Фізико-хімічна характеристика пива
1.2 Процеси окиснювального старіння пива та методи їх гальмування
1.2.1 Неферментативні процеси окиснення
1.2.2 Ферментативне окиснення
2. Експериментальна частина
2.1 Газоволюмометричний метод
2.2 Хемілюмінесцентний метод
2.3 Техніка безпеки
3. Окиснювальне старіння пива та його стабілізація
Висновки
Література
Вступ
Серед багатьох хімічних процесів, що ведуть до погіршення якості харчових продуктів, чи не найголовніше місце посідають окиснювальні процеси. Пиво у цьому відношенні є дуже вразливим, оскільки навіть незначний перебіг окиснювальних процесів у ньому призводить до суттєвого погіршення органолептичних якостей напою, які, як відомо, є найголовнішими критеріями якості для споживача. Такі процеси прийнято називати окиснювальним “старінням” чи органолептичним “старінням”(1).
Дуже важливим є те, що процеси окиснювального старіння не починаються лише при зберіганні напою. Вони супроводжують напій під час всієї технологічної схеми його виготовлення (1–3). Наслідком перебігу таких процесів є накопичення у пиві великого спектру речовин, що негативно впливають на смак та аромат напою. Але найбільш небезпечними є карбонільні сполуки, що і отримали відповідну назву – “карбоніли старіння”. В наслідок низького порігового значення смаку та аромату ці речовини є особливо небезпечними (4).
Існує багато наукових робіт, що присвячені питанню окиснювального старіння пива. Всі автори приходили до висновку, що ці процеси є неминучими і єдине, що можна зробити, – вплинути на швидкість їх перебігу, тобто підвищити антиокиснювальну стійкість напою (4–6). Було встановлено, що такі процеси йдуть за радикально-ланцюговим механізмом. Не дивлячись на такі успіхи, питання окиснювального старіння пива є й досі невирішеним.
Метою даної роботи стало вивчення процесів окиснювального старіння пива та перевірка можливості його стабілізації, з застосуванням для цього газоволюмометричного та хемілюмінесцентного методів дослідження.
1. Теоретична частина
1.1 Фізико-хімічна характеристика пива
Для осягнення всієї сукупності складних фізико-хімічних перетворень, які перебігають у пиві слід ознайомитись з хімічним складом цього природного об’єкту. Пиво має дуже складний хімічний склад. У залежності від сорту пива, технології його виготовлення та використаної сировини змінюється його кількісний та якісний склад. Для більшої зручності прийнято розділяти всі компоненти пива на головні та мінорні.
Головними компонентами пива є вода (91 – 93%), вуглеводи (1,5 – 4,5%), етиловий спирт (3,4 – 4,5%) та азотвмісні сполуки, які представлені, головним чином, амінокислотами та поліпептидами (0,2 – 0,65%). Переважна кількість вуглеводів пива (75 – 85%) складається з декстринів. На прості сахара (глюкоза, фруктоза, сахароза) припадає 10 – 15% від загальної кількості вуглеводів. І тільки 2 – 3% вуглеводів представлені складними сахарами (полісахариди та ін.). Пиво містить незначну кількість вищих спиртів (50 – 100мг/л), метиловий спирт практично відсутній .
Мінорними компонентами пива є мінеральні речовини, вітаміни, органічні кислоти, фенольні сполуки, гірки речовини, ароматичні речовини, біогенні аміни, естрогени.
У біологічно значимій кількості у пиві присутні іони калію, кальцію, магнію, фосфору, сірки, хлору. Також присутні іони заліза, міді, цинку та іони інших металів. У пиві багато вітамінів групи В, а саме В1, В2. Також присутній вітамін С, який іноді штучно додають до напою для запобігання процесів окиснення інших компонентів. Майже всі вітаміни присутні у пиві у фосфорельованій формі. Органічні кислоти представлені у пиві головним чином лимонною, піровиноградною, оцтовою, глюконовою, щавлевою кислотами. Цим і пояснюється те, що рН свіжого пива знаходиться у кислій області (рН = 5,1 – 5,4).
Загальний вміст фенольних сполук коливається в межах 150 – 300мг/л. Більш за все у пиві міститься антоцианидинів (лейкоцианидини, протоцианидини, лейкоантоцианидини). Всі гіркі речовини пива поділяють на мало- та високосмолисті. Малосмолисті речовини складаються з α – кислот (гумулони), β – кислот (лупулини) та інших сполук, які ще не ідентифіковані. На сьогодні ідентифіковано близько 70 компонентів, віднесених до класу ароматичних сполук пива. Всі ароматичні речовини поділяють на відновнену та окиснену фракції. Відновнена фракція включає у себе монотерпени (міріцен) і сескьютерпени (β-каріофілін, гумулін, фарнісин та ін.). Окиснена фракція складається з терпенових спиртів (ліналуол, гераніол), інших спиртів, альдегідів, кетонів, ефірів та їх похідних. З біогенних амінів у пиві були ідентифіковані кадаверин, путресцин, гістамін, тирамін. Естрогени є речовинами ,що створюють чіткий гормональний вплив на людину. У пиві таких речовин не так багато.
Вміст головних та деяких мінорних компонентів пива можна виразити у вигляді таблиці (табл.1.1; 1.2).
Таблиця 1.1 – Вміст головних компонентів пива
| Компонент | Вміст (мг/л) | |
| 1 | Вода | 91-93% |
| 2 | Глюкоза, сахароза, фруктоза | 2,6-2,9 г/л |
| 3 | Полісахариди та фрагменти пектина | 0,52-2,08 г/л |
| 4 | Етиловий спирт | 30 г/л |
| 5 | Вищі спирти | 50-100 мг/л |
Таблиця 1.2 – Вміст деяких мінорних компонентів пива
| Клас речовин | Вміст (мг/л) | |
| Мінеральні речовини | ||
| 1 | К | 160-450 |
| 2 | Na | 120 |
| 3 | Ca, Mg | 80 |
| 4 | P | 140 |
| 5 | Fe, Cu, Zn | не перевищує 1 |
| Вітаміни | ||
| 1 | В1 | 0,005-0,15 |
| 2 | В2 | 0,3-1,3 |
| 3 | С | 20-50 |
| 4 | Нікотинова кислота | 5-20 |
| 5 | Фолієва кислота | 110 |
| 6 | В6, Пантотенова кислота | 0,4-1,7 |
| 7 | Біотин | 5 |
| Органічні кислоти | ||
| 1 | Лимонна кислота | 130 |
| 2 | Піровиноградна кислота | 60 |
| 3 | Оцтова кислота | 90 |
| 4 | Глюконова кислота | 30 |
| 5 | Щавлева кислота | 15 |
| Фенольні сполуки | ||
| 1 | Антоцианідини | 14-77 |
| 2 | Еллагікова, протокатехінова, ванілінова, саліцилова, п-оксібензойна кислоти | не перевищує 1 |
| 3 | Фенол, ортокрезол, кумарини | не перевищує 1 |
| 4 | Катехіни | 5-55 |
| 5 | Епікатехіни | 9-24 |
| 6 | Рутин | 1-6 |
| 7 | Кверцетин | 5-125 |
| 8 | Хлорогенова кислота, Кофейна кислота | 2-20 |
| 9 | Кверцетрин, Мирицитрин | 1 |
| 10 | Куінова кислота | 1-5 |
| 11 | Ферулова кислота | 2-21 |
| 12 | Синапиковая кислота | 1-20 |
| 13 | Камферол | 5-20 |
| 14 | Галова кислота | 5-29 |
| Біогенні аміни | ||
| 1 | Кадаверин, Путресцин, Гістамін, Тирамін | 1-3 |
Оскільки сусло є попередником пива і окиснювальні процеси здатні зароджуватися вже у суслі, варто роздивитись хімічний склад і цього субстрату. Сусло практично не відрізняться від пива за якісним складом. Але кількісні склади цих субстратів сильно різняться між собою за вмістом головних та деяких мінорних компонентів пива (вуглеводи, етиловий спирт, азотвмісні сполуки, органічні кислоти та ін.). У порівнянні із пивом сусло містить значно більше сахарів, амінокислот, поліпептидів, органічних кислот, речовин ліпідної природи. Проте в суслі практично відсутні етиловий спирт, диацетил та інші продукти бродіння. Цією відмінністю і пояснюється різне відношення цих субстратів до окиснювальних процесів (у сусла дуже низька антиокиснювальна стабільність порівняно з пивом).
1.2 Процеси окиснювального старіння пива та методи їх гальмування
Існує великий об’єм емпіричних та теоретичних знань щодо процесів старіння пива. Найбільш добре відомий негативний вплив, що створює кисень протягом усієї технології виготовлення напою. Відповідальність за смак, що виникає у пива при його старінні, беруть на себе, у першу чергу, карбонільні сполуки, які у невеликих концентраціях сильно впливають і на аромат. При цьому кисень може додатково вплинути на утворення смаку, що виникає при старінні пива в результаті (7):
─ утворення важливих, з точки зору старіння речовин, що впливають на аромат пива;
─ утворення речовин -“попередників” цих речовин;
─ зменшення вмісту антиоксидантів, в результаті чого пізніше кисень може призвести до протікання окиснювальних реакцій.
До реакцій старіння пива можна віднести багато процесів окиснювальної природи. Проте головний внесок у формування смаку та аромату старого пива роблять процеси окиснення вищих спиртів, окиснювальний розпад ізогумулонів, реакція Майяра та розпад Штреккера, автоокиснення жирних кислот, ферментативний розпад жирних кислот, фотоокиснення жирних кислот, вторинне автоокиснення альдегідів та інші процеси. Умовно ці процеси можна поділити на процеси ферментативного та неферментативного окиснення. Велика частина з перелічених вище реакцій ідуть за участю вільних радикалів, утворення яких підсилюється під впливом кисню і відбувається, у першу чергу, в результаті каталітичних реакцій, що викликаються іонами заліза та міді (4).
На даний момент існує багато методів підвищення антиокиснювальної здатності пива. Одним із хімічних методів є введення антиоксидантів та рослинних екстрактів, що містять такі речовини. Для цього використовують сполуки – солі сірчистої та тіосірчистої кислот, а також α-аскорбінову та ізоаскорбінову кислоти та їх солі (3,7). Але використання аскорбінової кислоти, що активно рекламується, як вже встановлено, призводить до утворення дигідроаскорбінової кислоти, присутність якої у пиві у високих кількостях небажано через негативний вплив на якість напою. У той же час використання у пивоварінні відновлюючих речовин на основі сірки у великих кількостях також небажано через помітне погіршення смаку при зберіганні пива (3). Широко пропонується використання сбалансованої суміші сполук сірки з ерітроборатом натрію (3).
На даний момент часу проведено багато робіт по вивченню АОА рослинних екстрактів. При вивченні АОА екстракту деревини дуба, який використовується для виробництва вина, встановлено, що цей екстракт виявляє високу АОА у суспензіях клітин крові людини. За виявленим ефектом дубовий екстракт суттєво переважає деякі антиоксидантні біологічно активні добавки (8). Варто підкреслити, що вивчений екстракт, пригноблюючи утворення активних форм кисню, запобігає цитотоксичним ефектам вільнорадикального окиснення на самих ранніх стадіях.
Виявлення АОА у екстрактів дуба в біологічних системах, отриманого за ГОСТ Р 51299-99, відкриває перспективу досліджень, що направлені на пошук шляхів його використання у складі харчових продуктів.
Екстракти з трави м’яти, листя підбілу, плодів горобини, трави чебрецю і звіробою, отримані згідно ТУ У 18.483-98, вже тестувалися на пиві. Було встановлено, що їх введення у середині технологічної схеми виготовлення напою не тільки підвищує смакову стабільність готового напою, а також позитивно впливає на збереження гірких речовин хмелю, що у кінцевому результаті покращує смак пива (9).
1.2.1 Неферментативні процеси окиснення
До цього класу можна віднести процеси старіння пива, що йдуть без участі ферментів. Одним із таких процесів є окиснення вищих спиртів. Вони були відкриті на модельних розчинах пива. Меланоідини при окисненні спиртів є окислювачами. Відбувається перенос атому водню гідроксильної групи спирту у карбонільну групу меланоідинів, причому із спирту утворюється відповідний альдегід. Молекулярний кисень не бере участі у цій реакції безпосередньо, але він здатний її прискорювати. Ця реакція інгібується ізогумулонами та поліфенолами. Окиснення вищих спиртів у темряві протікає дуже повільно і здатність спиртів вступати у реакцію із збільшенням вуглеводневого радикалу, зменшується (4). Тому при умові правильного зберігання напою таким процесом можна знехтувати.
Окиснювальний розпад ізогумулонів також є небезпечним для смаку пива. Такий процес, особливо при підвищених температурах, призводить до суттєвого зменшення гіркоти напою (4). Було встановлено, що при окиснювальному розпаді ізогумулонів утворюються пропан-2-он, 2-метилпропаналь, 3,4-диметил-2-он, а також 2-метил-3-бутил-2ол (4,10). Меланоідини тут виступають у якості антиокисників (4).
Ще одним неферментативним процесом погіршення якості пива є реакція Майяра та розпад Штрекера. У цих процесах утворюються різні α-дикарбонільні сполуки, які в рамках розпаду Штрекера здатні реагувати з амінокислотами. При цьому амінокислота у ході декарбоксилювання переводиться в альдегід, в якому на один атом вуглецю менше:
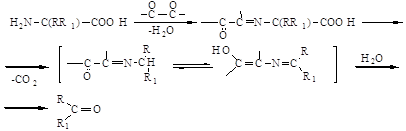
Цей процес каталізується у темряві за участю слідів іонів металів. На світлі розпад іде швидше, при цьому сприятливим фактором є присутність рібофлавіна, поліфенолів та спиртів (2,4).
Альдегіди, що утворюються в реакції Майяра та розпаді Штрекера, не належать до компонентів, що визначають “старіння” пива. Але розпад Штрекера вважається причиною формування хлібного смаку у пиві (11 – 13).
Автоокиснення ненасичених жирних кислот та їх ефірів відбувається чи не в кожному жировмісному харчовому продукті. Пиво не є виключенням.
У пиво потрапляє певна кількість жирних кислот із сировини (зерно та хміль).
Ячмінь вміщує близько 2% ліпідів, які представлені як тими, що вміщують, так і тими, що не вміщують гліцерин компонентами, а також вільними жирними кислотами.
Усі жирні кислоти, що входять до складу ліпідів, поділяють на дві групи: насичені, тобто ті, що не містять подвійних зв’язків, та ненасичені – ті, що містять подвійні зв’язки.
В ячменю, головним чином, містяться ненасичені жирні кислоти. У хмелю вміст ліпідів складає біля 3% сухої речовини, а вільні жирні кислоти – біля 20% його летких компонентів, що є досить значною величиною (2).
Саме ненасичені жирні кислоти та їхні етилові ефіри, що утворилися при бродінні, навіть при незначному потраплянні у пиво несуть у собі загрозу смаку напою. Тільки ненасичені жирні кислоти окиснюються досить швидко, щоб їх можна було вважати речовинами, які обумовлюють смак старого пива (11).
Так, ліноленова кислота окиснюється у 3 - 4 рази швидше порівняно з лінолевою, а остання, у свою чергу, - у 30 разів швидше масляної кислоти. На модельних розчинах пива було встановлено, що автоокиснення жирних кислот відбувається за радикальним механізмом (10).
При цьому радикал, у більшості випадків радикал пероксиду, відщеплює атом водню від молекули жирної кислоти. Новий радикал, що утворився, реагує з молекулярним триплетним киснем з утворенням радикалу пероксиду, який відщеплює атом водню у наступної молекули жирної кислоти та трансформується у гідропероксид жирної кислоти (4). Оскільки лінолева кислота характеризується максимальним вмістом у ячменю порівняно з іншими ненасиченими жирними кислотами, тому доцільно роздивлятись автоокиснення на її прикладі.
Загальна схема процесу автоокиснення є такою:
RH + R'O2•→ R'OOH + R•
R• + O2 → RO2•
RO2• + RH → ROOH + R•
(RH – лінолева кислота; R'O2•- пероксирадикал)
У випадку лінолевої кислоти радикал пероксиду атакує в паралельному до подвійного зв’язку положенні молекулу жирної кислоти, найчастіше у одинадцятого атома вуглецю, оскільки тут через можливу резонансну стабілізацію карбону через п’ять атомів вуглецю водень може бути відщеплений легше за все, але атака можлива і на атоми вуглецю 8 та 4, які також знаходяться поряд із подвійним зв’язком. У результаті утворюється ціла серія гідропероксижирних кислот, причому 9 та 13-гідропероксилінолева кислота характеризується найвищою концентрацією (4). Утворені гідропероксижирні кислоти не є стабільними і тому здатні розщеплюватися. Саме в результаті цього процесу і утворюються карбоніли старіння. Схематично для гідропероксилінолевої кислоти такий розпад може мати вигляд:
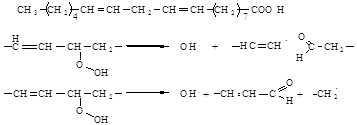
Тут зображено α-розщеплення. Залежно від того, розщеплюється молекула за варіантом А чи Б, утворюються різні продукти.
Розщеплення з позиції Б енергетично вигідне. З одного боку, утворюється ненасичений альдегід, а з іншого, – жирна кислота, що складається з короткого ланцюгу. Радикал гідропероксиду (•ОН), що утворився, є надзвичайно активним і може відщеплювати водень практично від усіх органічних молекул, оскільки виграш в енергії у результаті утворення зв’язку О─Н у будь-якому випадку більше енергії, яка необхідна на розщеплення зв’язку С─Н.
Іони важких металів створюють каталітичну дію на процеси окиснення. Окрім того, реакціям окиснення ненасичених жирних кислот сприяє підвищена температура, низьке значення рН та наявність окисників.
Можна роздивитись утворення радикалів у формі реакцій Фентона та Хабера- Вайса на прикладі пероксиду водню.
Реакція Фентона:
Fe2+ + H2O2 → Fe3+ + OH• + OHˉ
Fe3+ + H2O2 → Fe2+ + O2•ˉ + 2H+
Разом: 2H2O2 → OH• + OHˉ + O2•ˉ + 2H+
Реакція Хабера-Вайса:
Cu2+ + O2•ˉ→ Cu+ + O2
Cu+ + H2O2 → Cu2+ + OH• + OHˉ
Разом: O2•ˉ + H2O2 → O2 + OH• + OHˉ
Пероксид водню окислює іони заліза (II) до заліза (III), причому утворюється гідроксильний радикал та іон гідроксилу. Далі залізо (III) реагує з наступною молекулою пероксиду водню з утворенням двох протонів і одного супероксидного радикалу. Мідь (II) реагує з супероксидом з утворенням міді (I) та кисню.
Мідь (I) розщеплює молекулу пероксиду водню на іон гідроксила та гідроксильний радикал. Радикали, що утворилися, є надзвичайно активними та можуть призвести до зародження нових ланцюгів окиснення.
Поряд із автоокисненням ненасичених карбонових кислот іде процес фотоокиснення цих речовин. У фотоокисненні збуджений сенсибілізаторами синглетний кисень реагує, не потребуючи каталізаторів. Цей процес майже не залежить від температури. Продуктами цих процесів є гідропероксикислоти та альдегіди, що утворюються при розкладі таких кислот (3). Ця реакція залежить тільки від кількості кисню в субстраті та від наявності сенсибілізаторів, таких як рибофлавін (вітамін В2), хлорофіл, похідні порфірину та інші барвники. Взаємодія із синглетним киснем відбувається набагато швидше реакції з триплетним киснем, тому захисту пива від світла придають велике значення.
Було встановлено у пиві утворення різних насичених, а також однократно та двократно ненасичених альдегідів при фотоокисненні олеїнової та лінолевої кислот (14).
Ненасичені альдегіди, що утворюються при окисненні ненасичених жирних кислот, здатні окиснюватися далі. Так, при вторинному автоокисненні ненасичені альдегіди переводяться у насичені з більш коротким вуглеводневим радикалом. Було встановлено, що, наприклад, з транс-2-ноненалу можуть утворитися пентанал, гексанал, гептанал та октанал (10). Цим пояснюються повідомлення різних авторів про те, що концентрація транс-2-ноненалу, який утворюється на початку старіння, при глибокому окисненні поступово зменшується (4).
Усі вищеперелічені неферментативні окиснювальні процеси можуть бути зароджені металами змінної валентності. Ці процеси на даний момент широко вивчені. Оскільки залізо присутнє майже в усіх природних об’єктах, тому розгляд більш доцільно проводити на прикладі залізоініційованого окислення. Так залізо сприяє зародженню ланцюгів за схемою (15):
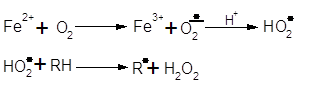
У випадку наявності у системі відновників з підходящим редокс-потенціалом (аскорбінова кислота та ін.) відбувається регенерація Fe3+ до Fe2+ за схемою:
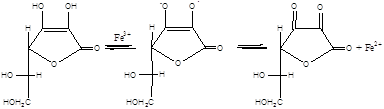
Відновлене залізо знову здатне зароджувати ланцюги окиснення.
1.2.2 Ферментативне окиснення
Окиснювальні процеси не починаються у готовому пиві, вони вже відбуваються при виробництві солоду та сусла. Ячмінь містить складну ферментативну систему. Активність цих ферментів сильно зростає при пророщуванні зерна. У цей час відбувається часткове розщеплення ліпідів під дією ліпаз. Дія ліпаз спрямована на складноефірну групу між гліцерином та високомолекулярними жирними кислотами. Утворені вільні карбонові кислоти здатні окиснюватися набагато легше, ніж їхні ефіри. Ферментом, що зумовлює окиснення ліпідів, є ліпоксигеназа. Під дією цього ферменту у присутності кисню повітря ненасичені жирні кислоти (олеїнова, лінолева, ліноленова) перетворюються у гідропероксиди, які здатні розпадатися на різних стадіях виробництва пива з утворенням карбонілів(2,4). Так, під дією ліпоксигенази утворюється такий діальдегід, як нонадінал, що відповідає за появу “огіркового” запаху солоду. Оптимальна умова дії ліпоксигенази рН=6,0 та температура 28 – 300С. Під час виготовлення сусла ліпоксигеназа активується і при значній кількості кисню відбувається активне утворення продуктів окиснення жирних кислот.
На стадії бродіння дріжджі відновлюють утворені карбоніли та гідроперекиси у відповідні спирти, які є безпечними для смаку напою. При розпаді гідроксикислот після бродіння утворені карбонільні речовини залишаються у пиві та погіршують його смак. Окрім ферментативних процесів окиснення з безпосередньою участю ферментів можна виділити процеси, де ініціаторами є метали змінної валентності (Fe), а ферменти виконують допоміжну роль. Як вже було описано у неферментативних процесах, залізо ініціює ланцюги окиснення за вищенаведеною схемою.
У випадку наявності у системі ферментів, де коферментом є НАДФН2, іони заліза відновлюються ланцюгом переносу електронів за наступною схемою (16,17):
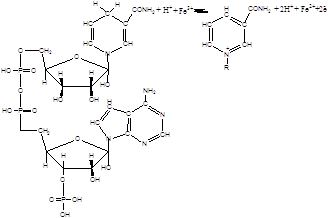
2. Експериментальна частина
2.1 Газоволюмометричний метод
Одним із простих і розповсюджених методів вивчення кінетики рідиннофазних реакцій окиснення органічних речовин є метод вимірювання кількості поглиненого кисню. Газоволюмометричний (ГВ) метод дозволяє вимірювати швидкість окиснення з великим ступенем точності при малих глибинах перетворення, коли впливом продуктів окиснення на кінетику реакції можна знехтувати.
Існують різні варіанти газоволюмометричних установок. Загальний принцип їхньої дії полягає у вимірюванні швидкості поглинання кисню при постійному тиску. Визначення кінетичних параметрів процесу інгібованого окиснення: період індукції, швидкість реакції з пероксильними радикалами, та ряд інших кінетичних характеристик проводили на установці для автоматичної реєстрації та запису поглинання кисню "Кулон-1" з фотоелектронним датчиком заводу Інституту хімічної фізики РАН (рис.2.1).
Установка складається з реакційної судини (1), зануреної у термостатовану комірку (2), термостатованої газової бюретки (3), електролітичної комірки з платиновими електродами (електроліт - насичений розчин щавлевої кислоти) (4), регулятора тиску (5), заповненого ундеканом і манометра (6), фотоелектроннного датчика (8), підсилювача датчика (9), стабілізатора струму (10). Перед початком досліду бюретка, регулятор тиску і реакційна судина з речовиною, що окиснюється, заповнюються до атмосферного тиску киснем. Для проведення окиснення реакційна судина нагрівається до певної температури за допомогою термостата при безперервному перемішуванні, після двоххвилинного прогріву з'єднується з бюреткою і регулятором тиску. Фотоелектронний датчик через стабілізатор струму з'єднаний з електролітичною коміркою. Під час реакції кисень з бюретки надходить у реакційну судину, при цьому тиск у системі падає, і у зв'язку з цим вмикається електролітична комірка. Газ, що виділився з комірки, підвищує тиск у термостатованому об'ємі і піднімає рівень ундекану в бюретці, в результаті чого тиск у системі вирівнюється. Швидкість просування меніска ундекана в бюретці пропорційна швидкості реакції.
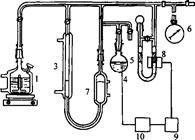
Рис. 2.1 Схема газоволюмометричної установки: 1 - реакційна судина; 2- термостат; 3 - газова бюретка; 4 - електролітична комірка; 5 - регулятор тиску; 6 - манометр; 7 - термостатований об'єм; 8 – фотоелектронний датчик; 9 - підсилювач датчика; 10 - стабілізатор струму.
Сила струму на електролізері складала 0.2 А. Установка дозволяє вимірювати швидкість поглинання кисню від 10-7-10-8 моль∙л-1∙с-1 і більше. Об'єм реакційної суміші дорівнює 5 мл, частота перемішування – 50-60 с-1. Вимірювання проводили в кінетичній області при тиску кисню 1 атм і температурі 313К та 343К.
2.2 Хемілюмінесцентний метод
Одним з методів вивчення кінетики хімічних реакцій може бути вимірювання хемілюмінесценції, тобто світіння, яке супроводжує хімічні процеси. Хемілюмінесценція (ХЛ) виникає в екзотермічних елементарних актах реакцій, тому її характеристики закономірно пов’язані з характеристиками реакцій. Детальне вивчення закономірностей хемілюмінесценції в реакціях, які йдуть за участю вільних радикалів, показало, що світіння виникає в елементарних актах рекомбінації вільних радикалів за схемою:
|