Вода и здоровье населения
Курсовая работа по дисциплине «Основы общей экологии»
Носкова Анна Евгеньевна 1 курс, гр. 05 ГЭБ
Таврический национальный университет им. В.И. Вернадского
Керчь. 2006
Данная курсовая работа состоит из трех глав. В нее включены 6 таблиц и 4 рисунка. При написании курсовой работы были использованы 15 источников литературы.
В данной работе рассмотрены водные ресурсы земли, влияние воды на здоровье населения ее благоприятное и неблагоприятное воздействие, требования потребителей и пользователей к качеству воды, а также показатели качества воды. Изучена вода как вещество, ресурс и необходимое условие жизни. Выяснено влияние химических примесей в воде на ее состав, свойства и качество. А также предложены экологически рациональные пути использования водных объектов; в частности основные тенденции использования водных ресурсов, охрана вод и предотвращение ее пагубного воздействия.
ВООЗ, ДСан ПиН, водообеспечение, водопользователи, водопотребление, водоснабжение, Мировой Океан, питьевая вода, растворы, минерализация, сточные воды, удельное водопотребление, качество воды, истощение вод, загрязнение вод, внутриклеточная жидкость, внеклеточная жидкость, рациональное использование природных вод.
Введение
Нельзя сказать что ты необходима для жизни: ты сама жизнь…
Ты наибольшее богатство в мире…
Антуан де Сент-Экзюпери.
Вода – весьма распространенное на Земле вещество. Она обеспечивает жизнь всем организмам, и является единственным источником кислорода в главном жизненном процесса на Земле – фотосинтезе. Все живые существа на 80-90 % состоят из воды. Потеря 10-20 % Согласно современным представлениям само происхождение жизни связывается с морем. Во всяком организме вода представляет собой среду, в которой протекают химические процессы, обеспечивающие жизнедеятельность организма; кроме того, она сама принимает участие в целом ряде биохимических реакций.
Ни одна сфера человеческой деятельности не обходится без использования воды, ведь она – это сама жизнь. Человек использует воду для питья, приготовления воды, и удовлетворения различных жизненных потребностей. Доля воды в теле человека близка к 60 %, но в отдельных органах и тканях она варьирует от 1 до 96 %.
Масса пресной воды на земном шаре составляет 31 млн. км3, основное количество которой (96%) сосредоточена в ледниках Гренландии, Антарктиды, горных массивов, в айсбергах и зоне вечной мерзлоты. Из всего количества пресной воды только около 1 % используется человечеством для удовлетворения своих потребностей.
Каждый житель Земли в среднем потребляет 650 м3 воды в год (1780 л в сутки). Однако для удовлетворения физиологических потребностей достаточно 2,5 л в день, т. е. около 1 м3 в год. Большое количество воды требуется сельскому хозяйству (69 %) главным образом для орошения; 23 % воды потребляет промышленность; 6 % расходуется в быту.
Цель данной курсовой работы – познакомиться с водой как уникальным веществом и ресурсом, а также влиянием ее на здоровье населения. Существенное внимание при этом уделяется причинам, экологическим следствиям и возможным путям решения экологических проблем.
Теперь возникает вопрос: почему же человеку так необходима качественная вода?
Когда-то люди довольствовались водой, которую они находили в реках, озерах, ручьях и колодцах. Но с развитием промышленности и ростом населения появилась необходимость гораздо тщательнее управлять водоснабжением, чтобы избежать вреда для здоровья человека и ущерба окружающей среды. Загрязнению подвержены все категории вод: океанические, континентальные, подземные, хотя и в разной степени.
Качество вод (это совокупность физических, химических, биологических и бактериологических показателей, которые удовлетворяют требования потребителей(15)), особенно пресных, стало одним из важнейших факторов здоровья населения. Всемирная организация охраны здоровья (ВООЗ) отмечает, что на планете от низкого качества воды ежегодно умирает около 5 млн. человек (в основном детей), а получают различной степени отравления или заболевания от 500 миллионов до 1 миллиарда человек, что 80% заболеваний на планете вызваны потреблением некачественной питьевой воды. Проблема чистой воды стоит перед многими странами.
Истощая или загрязняя воды, человек не только лишает себя данного ресурса, но и разрушает среды жизни многих организмов, нарушает свойственные им связи.
1. Вода и её свойства.
Физические свойства воды.
Чистая вода представляет собой бесцветную прозрачную жидкость, без запаха и вкуса. Однако в толстом слое водоёма она приобретает голубой цвет. После сильного охлаждения вода замерзает, превращаясь в лёд. Основные величины, которые характеризируют физико-химические свойства воды, приведены в таблице 1.1.(14)
Таблица 1.1 Физико-химические константы воды
| Показатель | Значение |
Температура, °С кипения замерзания, Критическая (ий) температура, °С давление, МПа вязкость, г/см Теплота плавления за 0,101 МПа(1 атм.), Дж/г сублимации льда за 0°С, Дж/г Удельная теплоёмкость льда за 0°С.Дж/(г · град) теплопроводность, Дж/(см · с · град) льда жидкости при 0° пара при 100°С электропроводность, См/см (Ом · см) льда при 0°С жидкости при 0°С жидкости при 50°С Диэлектрическая проницаемость жидкости при 20°С пара при 145°С и 0,101 МПа (1 атм.) Показатель заломления для линии Na при 20°С и 0,101 МПа (760 мм рт. ст.) Скорость распространения звука при 25°С, м/с Термодинамические величины: энтропия (S, газ, 101325 Па, 25 С), Дж/(моль К) теплоёмкость при 25°С, Дж/(моль К) Теплота электролитической диссоциации при 20°С, кДж/моль | 100 0 374,15 22,07(218,53 атм.) 0,325 332,43 2334,46 2,74 23,45 · 10-3 5,987 · 10-3 0,231 · 10-3 0,4 · 10 -8 1,47 · 10-8 18,9 · 10-8 81,0 1,007 1,33299 1496,3 188,846 76,07 -57,15 |
Плотность воды при переходе ее из твёрдого состояния в жидкое не уменьшается, как почти у всех других веществ, а возрастает. При нагревании воды от 0 до 4°С плотность её также увеличивается. При 4°C вода имеет максимальную плотность, и лишь при дальнейшем нагревании её плотность уменьшается.
Если бы понижение температуры и при переходе из жидкого состояния в твердое плотность воды изменялась так же, как это происходит у подавляющего большинства веществ, то при приближении зимы поверхностные слои природных вод охлаждались бы до 0°C и опускались на дно, освобождая место более теплым слоям, итак продолжалось бы до тех пор, пока вся масса водоема не приобрела бы температуру 0°C.Далее вода начинала бы замерзать, образующиеся льдины погружались бы на дно и водоем промерзал бы на всю его глубину. При этом многие формы жизни в воде были бы не возможны. Но так как наибольшей плотности вода достигает при 4°C, то перемещение ее слоев, вызываемое охлаждением, заканчивается при достижении этой температуры. При дальнейшем понижении температуры охлажденный слой, обладающий меньшей плотностью, остается на поверхности, замерзает и тем самым защищает лежащие ниже слои от дальнейшего охлаждения и замерзания.
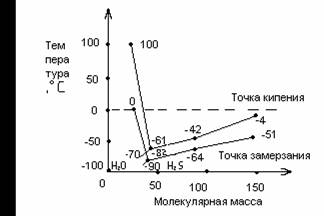
Аномальными для воды являются так же такие фундаментальные физические качества, как температура кипения и замерзания. Вода- гидрид кислорода своим молекулярным составом подобна гидридам элементов главной подгруппы шестой группы периодической системы элементов Д. И. Менделеева (H2S, H2Se, H2Te). Заряд ядра атома элемента, который их образует, определяет физические свойства веществ этого ряда.
![]() Исходя из определенных закономерностей для ряда H2Te - H2S, следовало бы ожидать, что вода должна кипеть при температуре -70°C, а замерзать – при -90°C. На самом деле при обычных условиях вода замерзает при температуре 0°C и закипает при температуре 100°C, то есть кривые поднимаются резко вверх вместо того, что бы опускаться (рисунок 1.1)(7).
Исходя из определенных закономерностей для ряда H2Te - H2S, следовало бы ожидать, что вода должна кипеть при температуре -70°C, а замерзать – при -90°C. На самом деле при обычных условиях вода замерзает при температуре 0°C и закипает при температуре 100°C, то есть кривые поднимаются резко вверх вместо того, что бы опускаться (рисунок 1.1)(7).
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() Почему же так происходит? Возможно, вода – уникальное исключение из правил. Причины этого явления пока еще до конца не установлены, хотя и предвидят, что это, очевидно, зависит от строения ее молекул и межмолекулярной структуры.
Почему же так происходит? Возможно, вода – уникальное исключение из правил. Причины этого явления пока еще до конца не установлены, хотя и предвидят, что это, очевидно, зависит от строения ее молекул и межмолекулярной структуры.
Молекула воды имеет угловое строение: входящие в ее состав ядра образуют равнобедренный треугольник, в основании которого находятся два протона, а в вершине ядро атома кислорода. Угол при
(рис. 1.1)
вершине равен примерно 106°, а стороны треугольника имеют длину 0,96 Å (ангстрема), т. е. 10 -10 м; расстояние между ядрами водорода HH =1,5 Å. Треугольник HOH находится внутри сферы, по которой движутся электроны. Центр инерции сферы С не совпадает с центром атома кислорода O и находится от него на расстоянии 0,13 Å(2).
В твердой воде (лед) атом кислорода каждой молекулы участвует в образовании двух водородных связей с соседними молекулами воды. Схема объемной структуры льда изображена на рисунке 1.2(4).
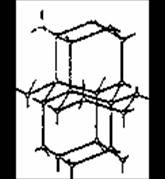 Образование водородных связей приводит к такому расположению молекул воды, при котором они соприкасаются друг с другом своими разноименными полюсами. Молекулы образуют слои, причем каждая из них связана с тремя молекулами, принадлежащими к тому же слою, и с одной из соседнего слоя. Структура льда принадлежит к наименее плотным структурам, в ней существуют пустоты, размеры которых несколько превышают размеры молекулы H2O.
Образование водородных связей приводит к такому расположению молекул воды, при котором они соприкасаются друг с другом своими разноименными полюсами. Молекулы образуют слои, причем каждая из них связана с тремя молекулами, принадлежащими к тому же слою, и с одной из соседнего слоя. Структура льда принадлежит к наименее плотным структурам, в ней существуют пустоты, размеры которых несколько превышают размеры молекулы H2O.
(рис. 1.2)
Итак, аномальность температур плавления льда и кипения воды связана с тем, что существование ее в условиях Земли в твердом и жидком состоянии также аномально. Нормальным было бы пребывание воды только в газообразном виде.
Ассоциированость воды обуславливает очень высокую теплоту ее парообразования. Например, для того чтобы выпарить 1 г воды, нагретой до 100ºC, требуется в шесть раз больше теплоты, чем для нагревания точно такого же количества воды от 0 до 80ºC. Благодаря этому вода является мощным энергоносителем на нашей планете. Способность воды накоплять большие запасы тепловой энергии дает возможность нивелировать резкие температурные колебания на земной поверхности в разные времена года и суток, т. е. Вода является регулятором температуры воздуха.
Среди физических свойств воды следует отметить ее высокое поверхностное натяжение – 72,7 ·10-7 Дж/см2 (при 20ºC). В этом отношении среди всех жидкостей вода уступает только ртути. Эта особенность воды проявляется в постоянном стремлении ее стягивать свою поверхность, несмотря на способность свободно размещать свой объем по форме занимаемого объекта. Высокое поверхностное натяжение воды приводит к тому, что она во время свободного падения или в состоянии невесомости приобретает форму шара, т. е. Геометрической формы с наименьшей поверхностью для этого объема.
Особенно наглядно выявляется поверхностное натяжение в смачивании – «прилипании» воды ко многим поверхностям. Установлено, что все вещества, например песок, стекло, глина, бумага, ткани и др., которые легко смачиваются водой, обязательно имеют в своем составе молекулы с атомами кислорода. Эта особенность воды дала возможность пояснить природу процесса смачивания: энергетически неуравновешенные молекулы поверхностного слоя воды получают способность образовывать дополнительные водородные связи с атомами кислорода указанных выше веществ.
Смачивание и поверхностное натяжение являются основой явления капиллярности. Последнее заключается в том, в узких каналах (капиллярах) вода может подниматься на высоту значительно большую, нежели та, которая допускается силой гравитации для столбика этого пересечения.
Итак, модифицируя структуру воды, можно достичь желаемых ее качеств. Это дает возможность эффективно использовать воду во многих сферах техники и хозяйственной деятельности.
После добавления в воду небольших количеств (части процента) полимерных соединений с большой полимерной массой, например полиакриламида, получают «скользкую» воду. Стеклянный шарик, погруженный в такую воду, падает в 2 – 2,5 раза быстрее, нежели в обычной, и быстро двигается в трубопроводах. Образование ассоциатов молекул воды с макромолекулами полимерных добавок способствует разрушению гидратных оболочек вокруг взвесей и ускоряет выпадение их в осадок.
Добавление небольших доз кремнесодержащих веществ придает воде резиноподобного вида. В этом случае вода из наклоненного сосуда не выливается, а вытягивается в виде эластичного жгута. При введении в воду небольших доз (сотые миллиграмма) металлов, например серебра, вода приобретает высокие бактерицидные и лекарственные качества и является прекрасным консервантом. «Серебряная вода» сохраняется в течении долгого времени, не утрачивая своих качеств питьевой воды.
Химические свойства воды.
Взаимодействие водорода с кислородом в газообразном виде при отсутствие катализатора медленно происходит только при 3000ºC по схеме(4):
2H2 + O2 = 2H2O.
При повышении температуры скорость реакции возрастает и при 550ºC она происходит со взрывом. При наявности катализатора, например платины, ход реакции ускоряется.
Молекулы воды отличаются большой устойчивостью к нагреванию. Однако при температурах выше 1000ºC водяной пар начинает разлагаться на водород и кислород(4):
2H2O ↔ 2H2 + O2.
Термическая диссоциация воды протекает с поглощением теплоты. Поэтому, согласно принципу Ле Шателье, чем выше температура, тем в большей степени разлагается вода. Однако даже при 2000ºC степень термической диссоциации не превышает 2%, т.е. равновесие между газообразной водой и продуктами ее диссоциации – водородом и кислородом - все еще остается сдвинутым в сторону воды. При охлаждении же ниже 1000ºC равновесие практически полностью сдвигается в этом направлении.
Кроме термической диссоциации вода способна также к электролитической, фитохимической и радиолитической диссоциации.
Электролитическая диссоциация воды в жидком виде происходит по схеме(4):
H2O = H+ + OH¯
Вода – весьма реакционноспособное вещество. Оксиды многих металлов и неметаллов соединяются с водой, образуя основания и кислоты; некоторые соли образуют с водой кристаллогидраты; наиболее активные металлы взаимодействуют с водой с выделением водорода.
С инертными газами вода образует гидраты, которые стойки при очень низких температурах. Вода окисляет кислородом в атомарном виде по схеме:
H2O + O2 = H2O2.
При обычных температурах вода реагирует с фтором с выделением атомарного кислорода(4):
H2O + F2 = 2HF + O.
Кроме того, могут образовываться O2, O3, H2O2, F2O, которые являются продуктами взаимодействия атомов кислорода друг с другом и с F2, H2O.
Во время растворения в воде хлора происходит реакция гидролиза хлора по схеме(4):
H2O + Cl2 = HCl + HOCl.
Вода обладает также каталитической способностью. В отсутствие следов влаги практически не протекают некоторые обычные реакции; например, хлор не взаимодействует с металлами, фтороводород не разъедает стекло, натрий не окисляется в атмосфере воздуха.
Вода способна соединятся с рядом веществ, находящихся при обычных условиях в газообразном состоянии, образуя при этом так называемые гидраты газов. Примерами могут служить соединения Xe · 6H2O, Cl2 · 8H2O, C2H6 · 6H2O, C3H8 · 17H2O, которые выпадают в виде кристаллов при температурах от 0 до 24ºC (обычно при повышенном давлении соответствующего газа). Подобные соединения возникают в результате заполнения молекулами газа («гостя») межмолекулярных полостей, имеющихся в структуре воды («хозяина»); они называются соединениями включения или клатратами(4).
Клатраты используют для разделения углеводородов и природных газов. В последнее время образование и разрушение клатратов газов (пропана и некоторых других) успешно применяется для обессоливания воды. Высокая экономичность и сравнительно мягкие условия осуществления этого процесса делают его перспективным в качестве промышленного метода опреснения воды.
Воде присущи слабые окислительные качества за счет атомов водорода с высшей степенью окисления ионов H+. При высоких температурах и наличии катализаторов вода окисляет метан, оксид углерода (ІІ) , углерод, железо, фосфор, при обычных условиях - щелочные и щелочноземельные и их гидриды(4):
CO + H2O = CO2 + H2 ↑ (катализатор Fe);
3Fe + H2O=Fe3O4 + 4H2↑;
CH4 + H2O = CO + 3H2↑ (1200 – 1400 °C без катализатора и при катализаторе – Ni или Co при 700 – 800 °C);
CaH2 + 2H2O = Ca (OH) 2 + 2H2↑;
2Na + 2H2O = 2NaOH + H2↑;
Ca + 2H2O = Ca(OH)2 + H2↑.
При растворении в воде кислотных и щелочных оксидов образуются соответственно кислоты и щелочи, а при растворении солей, кислот, оснований происходит их гидратация, т. е. присоединение молекул воды к молекулам растворенного вещества.
Природные воды почти никогда не бывают химически чистыми, так как содержат различные вещества в растворенном и взвешенном состоянии. В процессе взаимодействия гидросферы с атмосферой, литосферой и биосферой вода оказывает влияние на различные вещества, образуя истинные и коллоидные растворы. Истинные растворы – это такие, в которых растворенные вещества находятся в виде молекул и ионов с размерами частиц, не превышающими 10-7 мм. Коллоидные же растворы включают в себя не отдельные молекулы, а группы молекул и ионов с размерами растворенных частиц от 10-1 до 10-5 мм. Коллоидные растворы более устойчивы, но в природных водах они встречаются в незначительных количествах(6).
Природные воды различаются между собой по химическому составу, концентрации, соотношению в форме соединений между химическими элементами, находящимися в растворе.
1.3 Биологические свойства воды.
Вода принимает участие в биологическом круговороте веществ, в процессе которого несколько изменяется. Она является одной из важнейших составных живых организмов. Вода входит в состав различных тканей и органов. Так, 22 - 34 % ее содержится в костях, до 70 – 80 % - в жировой ткани и до 82 – 94 % - в нервных волокнах.
В теле грудного ребенка воды содержится – до 65 % . По мере роста и накопления жировых отложений содержание воды в организме уменьшается, достигая примерно 60 % (40 – 42 литра) у среднего взрослого мужчины и 50% - у женщины(12).
Автотрофы – зеленые растения – трансформируют неорганические соединения, в частности воду, оксид углерода (ΙV) и минеральные соли в органические вещества тела клетки, молекулярная структура которой неимоверно велика. Основой этого процесса является реакция фотосинтеза, в результате которой из углекислого газа и воды при участии хлорофилла и солнечной энергии появляются органические вещества, входящие в состав клеток и выделяется кислород:
hν
6CO2 + 6H2O + 2,72 кДж―—–→ C6H12O6 + 6O2↑.
Хлорофилл
Гетеротрофные организмы не способны синтезировать все вещества, которые необходимы для их существования. Они используют питательные вещества, которые входят в состав организмов авто- и гетеротрофов. При этом вещества экзометрически расщепляются и окисляются на более простые. Все процессы происходят при непосредственном участии живого вещества.
Ряд автотрофных организмов – продуцентов неспособны использовать солнечную энергию, поскольку не имеют соответствующих пигментов. Они получают энергию, необходимую для их существования, в результате окисления минеральных соединений.
Катаболизм, или процесс внутриклеточного разрушения питательных веществ, включает образование воды или участие ее молекул в окислении органических веществ и протекании восстановительных реакций. Последние обеспечивают использование химической энергии, которая содержится во всех питательных веществах. Движущая сила разрушения (анаэробного или аэробного) органического вещества обеспечивается действием ферментов (энзимов). Важнейшие особенности последних обусловлены их структурой. В зависимости от условий, в которых происходит процесс биологического окисления, получаются различные конечные продукты расщепления. Например, окисление глюкозы при аэробных условиях происходит по уравнению(14):
C6H12O 6 + 6CO2 = 6CO2 + 6H2+2,72 кДж / моль,
В анаэробных –
C6H12O6 = 3CO2 + 3CH4 + 144 кДж /моль.
Выход энергии при анаэробных условиях составляет всего 5,3 % количества энергии, которая высвобождается в аэробных условиях. Исходя из этого, в аэробных условиях процесс получения жизненной энергии более экономичен, нежели в аэробных. Поэтому клеточное деление при аэробных условиях продуктивней, и, и как следствие этого, процессы разрушения органических веществ до конечного состояния происходят интенсивнее.
Итак, в природе вода совершает беспрерывный биологический круговорот при участии зеленых растений, консументов и при помощи микроорганизмов-редуцентов, которые трансформируют органические вещества в неорганические (воду, метан, углекислый газ, аммиак, водород и др.), и вода снова возвращается к зеленым растениям-продуцентам. Микроорганизмы имеют большое значение для поддержания биологической активности и осуществления круговорота веществ, в данном случае воды, в природе.
1.4 Водные растворы и взвеси.
Поскольку вода является хорошим полярным растворителем, все природные воды – это растворы различных неорганических и органических соединений. В воде растворяются газы, жидкости и твердые вещества, с которыми она контактирует. Поэтому такие растворы являются гомогенными системами, свойства которых определяются как природой и структурным строением самого растворителя (воды), так и свойствами растворенных веществ. При этом образуется не инертная смесь нескольких соединений, происходит их взаимодействие, сопровождаемое взаимным влиянием растворителя на растворенные структуры и наоборот.
Органические вещества обычно пребывают в воде в молекулярно-растворенном состоянии. Для воды, которая имеет ажурную льдоподобную структуру, возможны два типа растворимости – замещение и проникновение. По первому типу растворимости молекулы растворенного вещества имеют размеры, близкие к размеру молекул воды, аналогичное силовое поле и замещают их в структурных образованиях, а по второму – молекулы растворенного вещества проникают в пустоты, образованные элементами структуры воды, если размеры молекул отвечают размерам пустот и они неполярны. Возможно также размещение в нескольких пустотах без существенного изменения углов связей между молекулами воды, если размеры молекулы растворенного вещества не отвечают одной из пустот. Для веществ, которые имеют полярные (OH¯, NH2¯) и неполярные (CH3¯ ,C2H2¯) группы, первые могут замещать молекулы воды в структурном каркасе, а другие обычно размещаются в пустотах. Известно, что вещества, которые содержат углеводородные группы, при так называемой гидрофобной гидратации содействуют образованию додекаэдрических, тетрокаэдрических и гексаэдрических структур из молекул воды.
В природных водах как примеси преимущественно содержатся взвеси минеральных веществ. Вода взаимодействует с ними по-разному. Часто она химически связана с породами, которые попадают в нее во время размывания берегов или в результате поверхностного покрова. Вода также способна образовывать адсорбционные стабилизованные слои на поверхности частичек. Считают, что физические качества связной воды, которая пребывает под действием активных центров частичек породы, отличаются от качеств воды в объеме.
Растворы организма: Существуют два основных типа жидкостей организма – внутриклеточные и внеклеточные. Внеклеточные жидкости состоят большей частью из плазмы крови (ок. 3 литров) и тканевой жидкости (ок. 12 литров). Внутриклеточная жидкость является главным ингредиентом клеток, и у среднего взрослого человека ее объем составляет примерно 25 литров.
Таблица 1.2. Содержание жидкостей в организме человека(12).
| Жидкость | Распределение | Количество |
Вода Внутриклеточная Внеклеточная | По всему организму Внутри клеток Плазма крови Лимфа Тканевая жидкость (промежутки между тканями) Спинномозговая жидкость Глаза и уши Костная жидкость Соединительная жидкость | 55% от общего количества 7,5 % 20 % 2,5 % 7,5 % 7,5 % |
Человеческое тело состоит из множества клеток, разделенных микроскопическими промежутками, по которым циркулирует тканевая жидкость. В нашем организме происходит непрерывный водный обмен с участием крови, межклеточных и тканевых жидкостей.
Кровь (состоящая из воды на 60 %) доставляет в растворенном виде необходимые клеткам (содержащим 80 % воды) питательные вещества. В процессе жизнедеятельности клетки вырабатывают углекислый газ, который необходимо удалять вместе с другими отходами. Вся эта работа выполняется при участии тканевой жидкости. Отходы сквозь стенки клеток попадают в тканевую жидкость, а оттуда сквозь стенки капилляров – в кровь. Одновременно из крови тем же путем поступает в клетки питание в виде кислорода и прочих химических веществ. И, наконец, отработавшая свой срок тканевая жидкость тоже вливается в кровоток.
Почти вся жидкость поступает непосредственно в кровь, но определенная ее часть возвращается в кровоток из лимфатической системы (рисунок 1.3), ведущей борьбу с болезнетворными микробами и содержащей молекулы – например, белковые, - которые слишком велики, чтобы проникнуть в кровь сквозь стенки капилляров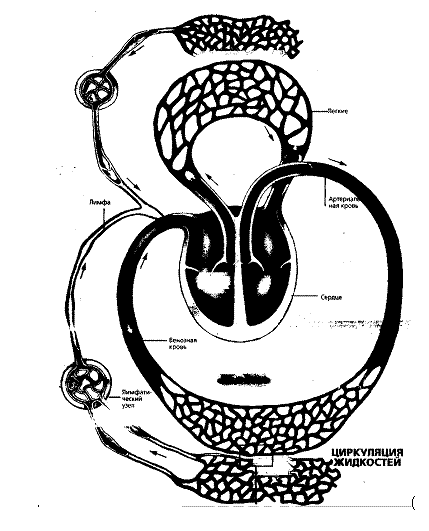 рис. 1.3)
рис. 1.3)
От многих продуктов жизнедеятельности клеток необходимо избавиться, и кровь несет их в почки, где проходит фильтрацию и очистку, а вредные вещества отделяются и растворяются в моче, состоящей главным образом из воды. Моча накапливается в мочевом пузыре и периодически выводится из организма.
Часть влаги непрерывно испаряется с потом при каждом выдохе. Небольшое ее количество присутствует и в кале (твердых экскрементах). В обычных условиях взрослый человек теряет за сутки 1,5 л воды.
Для нормального функционирования организму необходимо, чтобы содержание воды в нем оставалось более или менее постоянным, поэтому, непрерывно теряя воду, необходимо непрерывно восполнять ее запасы. Некоторое количество воды содержится в пище, но главная ее часть поступает с питьем. При обычной комфортной температуре и нормальном питании человек должен выпивать за день как минимум две трети литра воды. В жару, при тяжелых физических нагрузках или во время болезни организм теряет с потом гораздо больше жидкости, и, соответственно, возрастает потребность в питье. Таким образом, вода гораздо важнее для жизни, чем пища. Так как без ежедневного питья организм не сможет нормально функционировать. Если человек без особого вреда для себя может обходиться достаточно долго без еды, то без воды мы способны прожить гораздо меньше.
Потребление жидкости (в виде воды, фруктовых соков, чая или других напитков) отчасти зависит от привычки, и человек нередко пьет, фактически не нуждаясь в пополнении запасов воды. Если воды поступает в организм сверх надобности, то ее избыток выводиться вместе с мочой. И, напротив, при нехватке воды концентрация мочи повышается, чтобы организм не терял драгоценную воду.
Если организму требуется больше воды, чем ее потребляется, возникает чувство жажды. Им управляет гипоталамус – участок головного мозга, выполняющий ряд различных функций, в том числе регулирующий чувство жажды и голода. Нервные клетки гипоталамуса контролируют кровоток, а также уровень концентрации солей и прочих веществ в крови. Если общий объем крови уменьшается, указывая на то, что организм нуждается в воде, нервные клетки стимулируют выработку гормона. Вызывающего сухость в горле, и тогда возникает чувство жажды.
То же гипоталамус регулирует интенсивность работы почек и, Следовательно, объем жидкости, которая выводиться из организма с мочой. В управлении чувством жажды гипоталамус действует совместно с нервными окончаниями полости рта и горла. Они, в свою очередь, соединены со стволом головного мозга и, получив от него сигнал, что выпито достаточно жидкости, гасят чувство жажды еще до того, как вода отправится циркулировать по организму.
Помимо доставки питания к клеткам, удаления отходов и борьбы с болезнями, внеклеточные жидкости выполняют еще ряд важнейших функций. Одна из них заключается в переносе и распределении по тканям растворенных солей и других химических веществ, например, вырабатываемых организмом гормонов и ферментов (энзимов). С помощью солей приводиться в действие мышцы и нервные клетки, а гормоны и ферменты регулируют и контролируют многие функции организма.
Некоторые жидкости выполняют и роль защитной подушки. К примеру, головной мозг как бы плавает в спинномозговой жидкости. Которая не только снабжает его питательными веществами, но и действует как амортизатор, смягчая удары. Брюшина, окружающая и оберегающая внутренние органы брюшной полости (желудок, печень, селезенку и кишечник) тоже содержит некоторое количество жидкости, которая, как хорошая смазка, смягчает взаимное трение между органами. Точно также действует жидкость, заполняющая околосердечную сумку и плевру вокруг легких.
Растворенные соли необходимы не только для четкой работы мышц и нервов, но и для поддержания нормального жидкостного обмена между кровью, тканевой жидкостью и клетками.
Пронизанные кровеносными капиллярами клеточные оболочки полупроницаемы. Это значит, что для жидкостей и мельчайших молекул путь свободен, а для более крупных молекул и растворенных в жидкостях твердых веществ – нет. Процесс проникновения жидкости и мелких молекул сквозь эти полупроницаемые барьеры называется осмосом, а поддерживаемый с его помощью баланс – осмотическим давлением. Весь обмен питательных веществ и продуктов жизнедеятельности, т. е. Сама основа равновесного состояния живого организма, обеспечивается с помощью этого давления.
Оптимальный баланс содержания солей в крови и тканях имеет огромное значение для организма человека. Благодаря этому поддерживается необходимое осмотическое давление и не допускается всасывание избыточной жидкости из крови в клетки. Когда во время болезни или в жару человек сильно потеет, его кровь теряет соли, и если эту потерю быстро не восполнить с пищей, то концентрация солей в тканях становится выше, чем в крови.
Как результат, осмотическое давление в клетках повышается, и вода из крови переходит в тканевые жидкости и клетки. И вот клетки уже заполнены до краев, а организм тем временем испытывает острый дефицит внеклеточной жидкости. При значительном обезвоживании плазмы крови у больного может случиться шок, который нередко становиться следствием перегрева или сильной кровопотери.
Концентрация солей в жидкостях организма контролируется почками под воздействием антидиуретического гормона АДГ. Этот гормон вырабатывается гипофизом по команде гипоталамуса, управляющего чувством жажды.
Когда в ткани или клетки просачивается слишком большое количество воды при недостаточном обратном оттоке, происходит скопление жидкости. В медицине это состояние называют отеком, или водянкой.
Чаще всего отекают руки и ноги, но от водянки не застрахованы и другие органы. Одной из форм лечения отека является прием диуретических средств, которые побуждают почки выводить из организма соль, а вместе с ней и избыток воды. Отек возникает в результате различных заболеваний, но может быть и следствием хронического недоедания, когда нехватка белка в крови приводит к перенасыщению тканевой жидкости избыточной водой, и тело в результате опухает. От этого отека избавляет богатая белками диета.
2. ВОДА КАК РЕСУРС И УСЛОВИЕ ЖИЗНИ.
2.1 Водные ресурсы земли.
Вода – самое распространенное вещество в природе. Она находится в свободном состоянии (океаны, моря, озера, реки, ледники), содержится в минералах, горных породах, почве и входит в состав живых организмов (50 – 90 % их массы, а в теле медузы и огурца – около 98 %). Планета Земля содержит около 16 млрд км3 воды, что составляет 0,25 % ее массы. Основная часть воды находится в глубинных зонах (мантии) Земли. По месту размещения воду разделяют на атмосферную, поверхностную и подземную(15).
Все водные источники (океаны, моря, реки, озера, водоемы, ледники, болота, атмосферные и подземные воды) входят в состав Мирового океана и образуют гидросферу планеты Земля. Большая часть поверхности планеты (около 71 %) покрыта водами Мирового океана. Общий объем воды в нем составляет 1 370 323 тыс. км3 – около 94 % всей воды планеты. Верхняя граница гидросферы проходит на высоте нижних слоев стратосферы до высоты озонового экрана (приблизительно на высоте 20 км). Вода в атмосфере находиться в парообразном состоянии и перемещается. Нижняя граница гидросферы проходит в литосфере на глубине 3 – 3,5 км от поверхности земли.
Кроме вод Мирового океана наибольшее количество воды находится в литосфере – подземные воды гидросферы (грунтовые, подгрунтовые, межпластовые безнапорные и напорные воды, воды трещин карстовых пустот). Подземные воды составляют 60 млн км3 , или 4,12 % общего объема, и находятся на различных глубинах (до нескольких сотен метров). Однако в зоне активного водообмена их содержится меньше чем 4 млн км3. В ледниках находится 24 млн км3 воды, в озерах и водохранилищах – 280 тыс. км3, в почвах – 85 тыс. км3, в атмосфере – 14 тыс. км3. Вода, находящаяся в руслах рек, составляет только 1,2 тыс. км3 (таблица 2.1)(14).
Таблица 2.1 Распределение массы воды гидросферы.
| Составляющая гидросферы | Масса воды, 1015 т | Часть суммарной массы, % |
Мировой океан Подземные и грунтовые воды Снеголедниковые образования Озера, пруды Почвенная влага Болта Атмосферная влага Реки, ручьи Всего | 13338 (1386) 100 (4 - 200) 26 (24 - 30) 0,28 (0,18 – 0,17) 0,1 (0,06 – 0,1) 0,1 (0,01 – 0,1) 0,0014 0,012 (0,002) 1464,4826 | 91,363 6,828 1,776 0,019 0,0068 0,068 0,0000955 0,0000820 100 |
К поверхностным водам принадлежат воды океанов, морей, озер, рек, болот, ручьев и штучных озер. Океаны, моря и некоторые озера – соленые. В реках, большинства озер, прудах, штучных водохранилищах, болотах и ручьях вода пресная. Последнюю, как правило, используют для хозяйственного водообеспечения. Итак, на Земле большинство вод (почти 1.5 млрд км3) содержит значительное количество растворенных солей. К ним принадлежат воды океанов, морей, некоторых озер и большинства подземных вод вне зоны активного водообмена.
Пресная вода составляет незначительную часть гидросферы (менее 4 %). Основная масса пресной воды (до 77 %) находится в снего-ледниковом покрове(5). Распределение воды в гидросфере достаточно неравномерно, про это свидетельствуют данные таблицы 2.1.
Наибольшие запасы пресной воды сосредоточены в снего-ледниковых покровах Антарктиды, Гренландии и Арктики. Вода в ледниках пребывает в твердом состоянии и характеризуется наименьшим содержанием солей среди известных водных источников в природе. Максимальная минерализация ледниковой воды составляет 3мг/л. Человечество, рассматривая водный баланс будущего, с надеждой смотрит на эту огромную «кладовую» пресной воды, где сосредоточе