Синтез ЖК. Дендримеры
Синтез ЖК
ВВЕДЕНИЕ
В последнее время активно развивается новая область химии высокомолекулярных соединений, связанная с синтезом трёхмерных суперразветвлённых полимеров и олигомеров, называемых дендримерами . Этот класс соединений интересен тем, что при их получении c каждым элементарным актом роста молекулы количество разветвлений увеличивается в геометрической прогрессии. В результате с увеличением молекулярной массы таких соединений изменяются форма и жесткость молекул, что, как правило, сопровождается изменением физико-химических свойств дендримеров, таких как характеристическая вязкость, растворимость , плотность и др.
Существующие синтетические подходы позволяют получать регулярные дендримеры, макромолекулы которых обладают строго определённой молекулярной массой. Кроме того, следует отметить, что многие свойства дендримеров, такие как, например, температура стеклования и другие, в существенной степени зависят от химической природы концевых групп, располагающихся на поверхности таких шарообразных молекул. Всё вышесказанное вызывает интерес химиков-исследователей к синтезу дендритных макромолекул. Так, к настоящему времени синтезированы дендримеры на основе простых и сложных полиэфиров, полиамидов , полифениленов , полисилоксанов (3,), поликарбосиланов (,) и др. В литературе также имеются сведения о получении дендритных блок-сополимеров, содержащих на одной половине “молекулы-шара” гидрофобные фенильные поверхностные группы, а на другой - гидрофильные карбокси- группы , или на одной половине электроноакцепторные CN-группы, а на второй - электронодонорные фенилокси- группы . Перечисленные и многие другие публикации свидетельствуют об огромных возможностях молекулярного дизайна дендритных макромолекул.
В данной работе и вышедшей по ней публикации предлагается новый тип дендримеров - жидкокристаллические (ЖК) дендримеры, которые отличаются от ранее описанных в литературе (,) тем, что мезогенные группы, “отвечающие” за реализацию ЖК состояния, находятся только в поверхностном слое дендритных макромолекул регулярного строения.
Такие ЖК дендримеры представляются нам интересным объектом для исследований по следующим основным причинам.
Прежде всего следует отметить необычный, экзотический характер строения таких соединений, где каждая суперразветвлённая молекула может быть представлена в виде сферы, внутренняя часть которых состоит из немезогенных блоков, а наружная поверхность сферы образована мезогенными фрагментами. Подобное “микрогетерогенное” строение молекул должно предопределять склонность таких систем к микрофазовому разделению, подобно тому, как это имеет место в блок- и привитых сополимерах, склонных к образованию различного рода мезоморфных структур ламеллярного, гексагонального и др. типов . И в этом смысле изучение структурной организации дендримеров, построенных из разнородных блоков, часть из которых склонна к формированию ЖК фазы несомненно представляет существенный научный интерес как с точки зрения их молекулярной, так и надмолекулярной структуры.
Возможность создания “ЖК оболочки” (рубашки) вокруг центрального ядра, образованного дендритной матрицей, безусловно интересна и с практической точки зрения, поскольку открывает перспективы для использования таких соединений в качестве активных модификаторов механических, реологических и трибологических свойств полимеров, а также создания на их основе селективных мембран и носителей лекарственных препаратов.
Изучение ЖК дендримеров, по-существу, только начинается, а быстро растущее число опубликованных работ, посвящённых суперразветвлённым молекулам, не содержащих мезогенных групп, дают основание надеяться на привлечение внимания исследователей, работающих в области жидких кристаллов и ЖК полимеров к изучению этих необычных объектов.
Глава I. ЛИТЕРАТУРНЫЙ ОБЗОР
1. Дендримеры - новый тип высокомолекулярных соединений.
Термин дендример (“dendrimer”) происходит от английского слова “dendritic” - “ветвящийся, древовидный”. Его ввёл Д. А. Томалиа на первой международной конференции по полимерам, проходившей в Японии в августе 1984 г. . Синонимом слова дендример является арборол (“arborol”), которое ввёл Г.Р. Ньюком . Оно происходит от латинского “arbor”, что означает дерево. Сами эти названия говорят о специфичности строения таких соединений.
И действительно, если посмотреть на схематическое двухмерное изображение молекулы дендримера (рис. 2), в ней можно выделить центральный атом (или группу атомов), называемых начальным центром и отходящие от него “ветви”. Количество последних зависит от функциональности начального центра (NC) и обычно равно 1, 2, 3 или 4. Собственно дендримерами называют дендритные макромолекулы с NC і 2. В случае же NC =1 такие структуры принято называть монодендронами или просто дидендронами (см. рис. 2) (1). Тогда дендримеры можно разделить на дендроны, тридендроны и т.д.
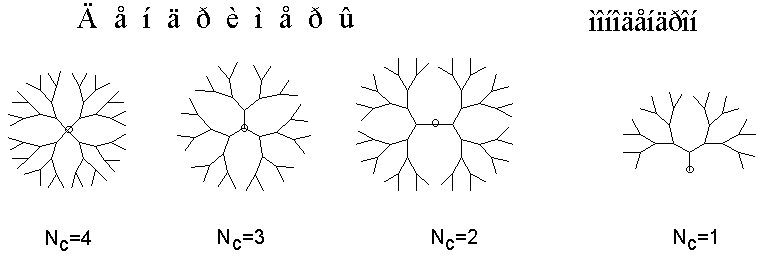
Рис. 2. Схематическое изображение дендритных макромолекул (двухмерная проекция, NB = 2 во всех случаях).
Разветвлённость каждой ветви дендримера (дендрона) зависит от функциональности элементарного звена такой макромолекулы (NB) и обычно равна 2 или 3. Для примера на рис. 2 представлены дендримеры с NB = 2.
Если через центр дендритной молекулы мысленно провести окружности, проходящие через существующие и потенциальные точки ветвления дендримера (рис. 3), и пронумеровать их, начиная с 0, можно увидеть, что благодаря симметричности молекулы все точки ветвления попадут на окружности. Максимальное полученное таким образом число называется номером генерации G данного дендримера .
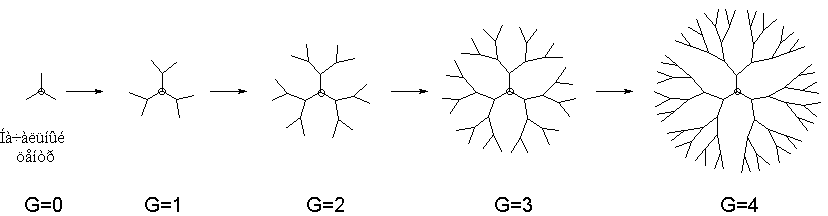
Рис. 3. Двумерные проекции дендримера с NC = 3 и NB = 2 как функция генерации (G) 0 ё 4.
Используя введённые выше понятия функциональности центра NC и элементарного звена NB, а также номера генерации G, можно вычислить количество концевых групп, повторяющихся звеньев (степени полимеризации) и молярную массу дендримера как функцию генерации. Для идеальных систем справедливы следующие соотношения (1) :
Как видно из представленных формул, число концевых (поверхностных) групп в молекуле дендримера на каждой генерации растёт в геометрической прогрессии. В то же время размер молекулы, а следовательно и “поверхность”, доступная для размещения концевых групп на каждой генерации увеличивается лишь в квадратичной зависимости. Это приводит к тому, что плотность упаковки поверхностных групп дендримера тоже растёт от меньших генераций к большим. В следствии этого изменяются форма и жёсткость молекул дендримеров от рыхлых структур, по форме напоминающих “морские звёзды”, до жёстких шаров (1). Однако это не может продолжаться до бесконечности, и наступает момент, когда все концевые группы уже не могут разместиться на поверхности сферы, образованной молекулой (так называемый парадокс Мальфусиана , поскольку плотность упаковки при этом превысила бы 1. В результате регулярный рост макромолекулы становится невозможным, однако дальнейший нерегулярный рост такой шарообразной молекулы вполне реален. Таким образом возникает предельное число генераций, до которого возможно формирование индивидуальных дендримеров.
Интересно отметить тот факт, что ещё в 1982 (!) году, т. е. до появления первых синтетических работ в этой области и даже самого термина дендример, вышла работа (21), в которой теоретически предсказывается существование этого предела. Более того, в ней предлагается простой метод расчёта предельной генерации для любых конкретных дендритных систем, основанный на вычислении теоретической плотности упаковки молекулы дендримера.
Остановимся подробнее на методах синтеза последних.
1.1. Основные подходы к синтезу дендритных макромолекул.
Основные предпосылки создания макромолекулярных систем восходят к работам П. Флори , который высказал предположение о возможности получения в высокофункциональной системе не сшитого и не циклического, а сильно разветвлённого полимера. Для достижения такого результата необходимо выполнить одно главное условие, назовём его условием Флори. Итак, если в мономере содержится более двух функциональных групп, одна из которых А, а остальные В, и если А не реагирует с А, и В с В, а имеет место только взаимодействие А с В, в результате которого образуется химическая связь А-В, то в этих условиях и может образоваться несшитый и не полициклический полимер, представленный на рис. 4.
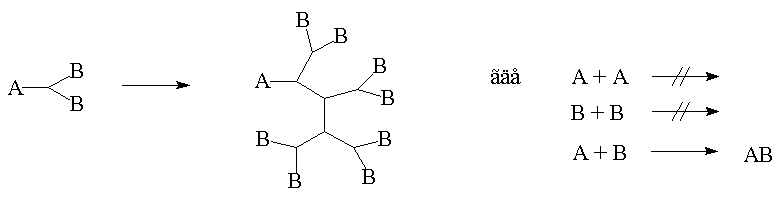
Рис. 4. Схема неуправляемого синтеза дендримеров.
Если же теперь представить, что в том же самом исходном мономере не только А не взаимодействует с А, и В с В, но и А не взаимодействует с В, а образование химической связи происходит лишь при взаимодействии А с С, причём функциональная группа В на определённом этапе может быть трансформирована в С, то в результате использования такой схемы может быть реализован процесс полностью контролируемого роста молекулы (рис.5).
Процесс, представленный на рис. 4, называют неуправляемым синтезом дендримеров, поскольку размеры и молекулярная масса получаемого продукта определяются реакционной способностью образующихся промежуточных соединений и рядом кинетических факторов. При этом получается полидисперсный продукт нерегулярного строения. Преимуществом такого подхода является его одностадийность.
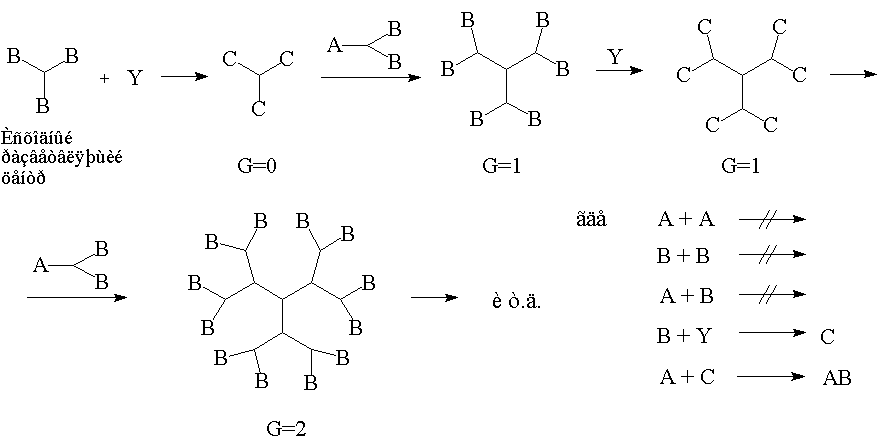
Рис. 5. Схема управляемого синтеза дендримеров.
Вторую схему (рис. 5) называют управляемым синтезом дендримеров, поскольку продукт, полученный на каждой стадии, можно выделить в виде индивидуального соединения. В этом случае решающее значение имеет принцип защиты реакционных групп (А не реагирует с В, а реагирует только с С). При управляемом синтезе полимер собирается “послойно” с помощью последовательности чередующихся реакций наращивания “слоя” и снятия защиты. В результате получается монодисперсный продукт, молекулярная масса и размеры которого строго определяются числом проведённых реакций или номером генерации G, означающем число наращенных слоёв. При этом можно остановиться на любой стадии и получить дендример любой генерации и с любыми функциональными группами на поверхности.
Рассмотрим теперь конкретные примеры синтезированных на сегодняшний день дендримеров.
1.1.1 Неуправляемый синтез.
В самых первых работах для описания систем, имеющих случайную разветвлённую топологию и широкое молекулярно-массовое распределение, использовался термин “поликонденсаты”. Так, описаны методы синтеза, основанные на конденсации бензилгалогенидов по Фриделю-Крафтсу и поликонденсации 2,5,6-трибромфенола с образованием арилового эфира .
Более поздние примеры поликонденсации такого типа приводят к образованию полностью ароматических, полиэфирных, металлоорганиче-ских и кремнийсодержащих гиперразветвлённых систем. В основном конечные продукты существенно более полидисперсны, чем продукты, полученные по управляемому методу (см. гл. 1.1.2.) с идеальностью ветвления 50-75%.
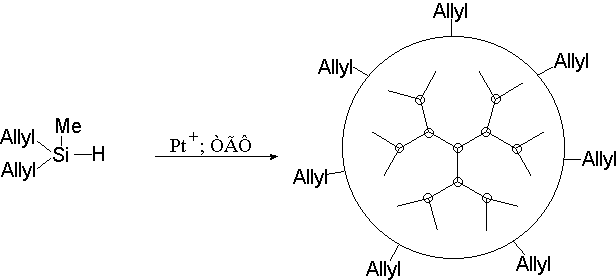
Рис. 6. Схема синтеза саморегулирующихся кремнийорганических дендритных систем (10).
Так, Музафаров с соавт. (10) получили различные кремний-органические дендритные системы с помощью реакции гидросилили-рования на основе простейших мономеров типа винилметилсилана, дивинилметилсилана, диаллилметилсилана и др. (рис. 6).
Авторы называют данные системы саморегулирующимися. Саморегуляция происходит потому, что с увеличением плотности упаковки в поверхностном слое молекулы дендримера реакционная способность концевых групп уменьшается. В то же время реакционная способность “отставших”, непрореагировавших групп в предыдущем слое остаётся высокой, в результате чего они как бы “навёрстывают упущенное”, реагируя быстрее до тех пор, пока реакционные группы на этом участке окажутся в поверхностном слое. Таким образом, стерические затруднения в поверхностном слое в случае нерегулярного роста приводят к образованию шарообразных молекул примерно одинакового размера.
Выход в зависимости от природы мономера и условий реакции составлял 80 - 90 %. Полученные продукты представляли собой вязкие жидкости с молярной массой от 6ґ103 до 3ґ105 в зависимости от условий реакции.
Другим примером таких систем является одностадийный синтез гиперразветвлённых полиариловых эфиров посредством термической самоконденсации 3,5-бис(триметилсилокси)бензоилхлорида (рис.7).
Выход продукта составлял 80% со средневесовой молекулярной массой от 3ґ104 до 2ґ105. Степень разветвления в этих системах по данным ЯМР составляла 55-60%. Полидисперсность полученных продуктов варьировалась в пределах 1.9ё2.9 в зависимости от температуры реакции.
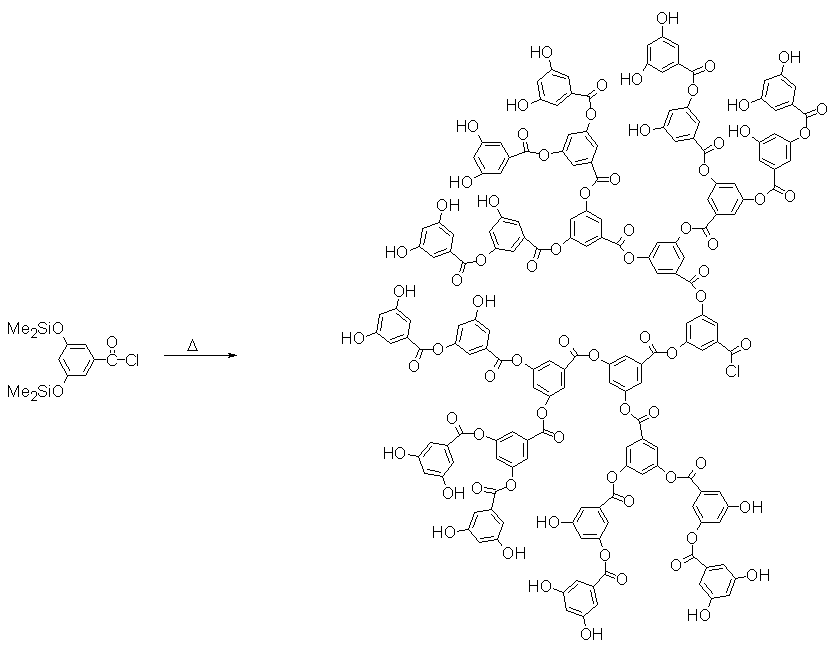
Рис. 7. Схема неуправляемого синтеза дендритных полиариловых эфиров (26).
1.1.2. Управляемый синтез.
В последних обзорах, посвящённых дендримерам (1,2), управляемый синтез стали подразделять на дивергентный и конвергентный подходы.
Описанная выше (см. гл. 1.1) и ставшая уже классической схема синтеза дендримеров путём повторяющихся реакций наращивания слоя и снятия защиты, начинающаяся с исходного разветвляющего центра (рис. 5), получила название дивергентной. Отличительной особенностью этой схемы является быстрое увеличение числа реакционных центров, располагающихся на поверхности дендритной молекулы с возрастанием номера генерации. Это, в свою очередь, приводит к трудностям очистки конечных соединений от продуктов неполного замещения поверхностных функциональных групп, если таковые имеются в системе. Проблема очистки связана с очень малым различием молекулярных масс дендримеров с полностью прореагировавшими поверхностными группами и продуктов неполного замещения. Различие молярных масс таких соединений не превышает нескольких процентов.
Для преодоления указанного выше недостатка Фреше , а также Нинан и Миллер независимо друг от друга предложили другой подход, названный ими конвергентным методом. Если в случае дивергентного синтеза рост дендритной молекулы происходит от центра к периферии, то в данном случае, наоборот, дендример “собирается”, начиная с поверхностных групп.
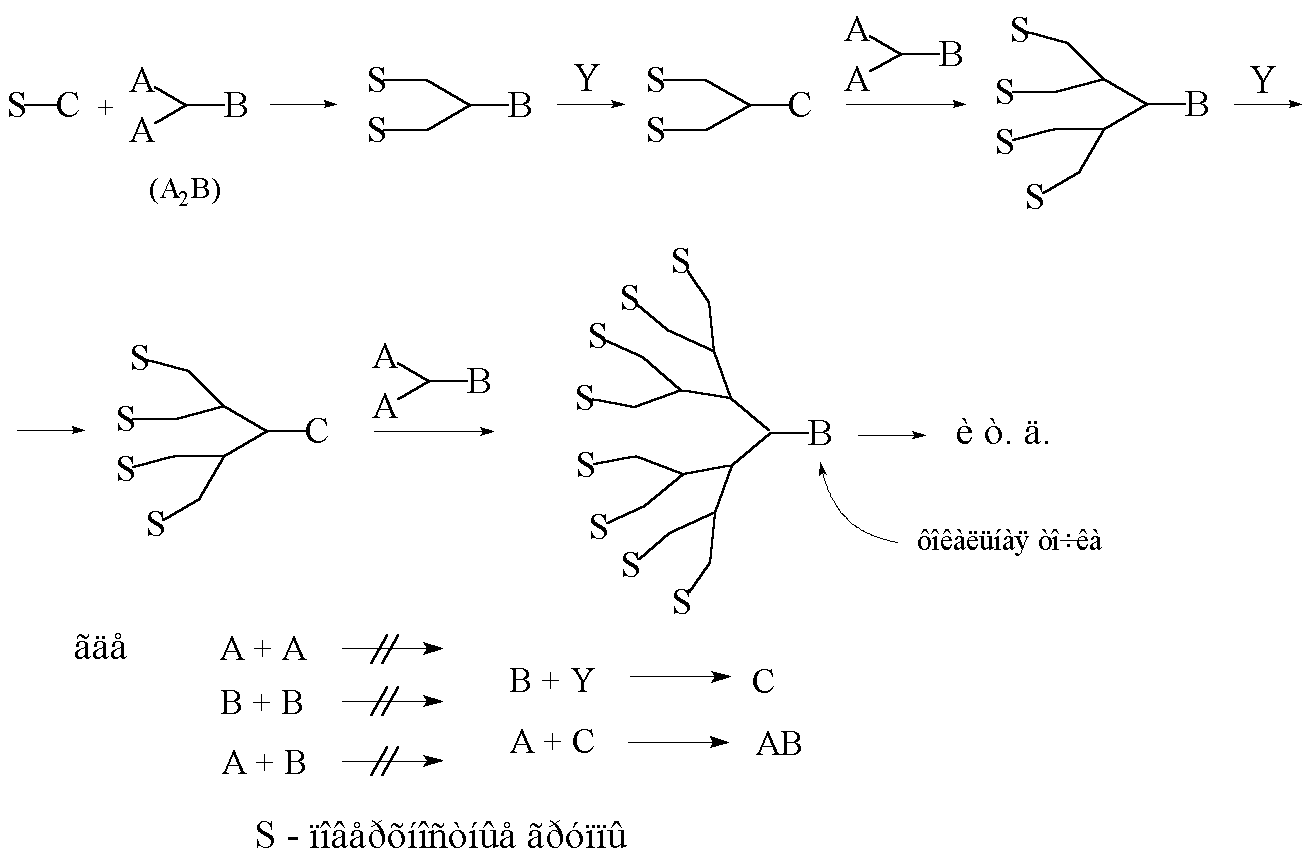
Рис. 8. Схема конвергентного синтеза дендронов.
Придерживаясь системы обозначений, введённых ранее (см. гл. 1.1), конвергентный рост монодендрона можно представить схемой, изображённой на рисунке 8. Стоит напомнить, что при управляемом синтезе химическая связь образуется только при взаимодействии функциональных групп А и С. Рост дендрона начинается со взаимодействия будущих поверхностных групп S с разветвлённым мономером типа А2В. Затем происходит активация образованного “димера” (перевод группы В в С) и опять взаимодействие с мономером А2В с образованием “тетрамера” и т.д. При этом, независимо от номера генерации, на каждой стадии роста дендрона количество реагирующих групп остаётся постоянным и обычно равно 2 или 3.
Таким образом получается дендрон, содержащий в своей так называемой “фокальной точке” реакционноспособную группу С или скрытую функциональность В. Для получения дендримера необходимо присоединить эти дендроны к разветвляющему центру (рис. 9).
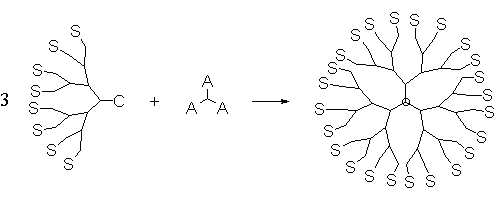
Рис. 9. Схема получения дендримеров из моноденронов.
Следует отметить, что монодендроны можно получить и дивергентным способом, а затем их присоединить к разветвляющему центру по этой же схеме с образованием дендримера.
Как уже отмечалось выше, преимуществом конвергентного подхода является малое число реагирующих групп на каждой стадии, что, в свою очередь приводит к минимальному числу промежуточных продуктов (продуктов недозамещения). Кроме того, различия в молекулярной массе конечных, исходных и промежуточных продуктов столь велико (в 1.5 ё 2 раза), что позволяет легко выделить целевое соединение в чистом виде.
Однако существенным недостатком данного метода являются стерические затруднения, возникающие на стадии присоединения монодендрона к разветвляющему центру. Здесь столь малое число реакционных групп (фактически единственная у монодендрона - фокальная точка) играет отрицательную роль. В реакционной системе оказывается довольно низкая концентрация реагирующих групп, активность которых ещё более снижена большим количеством “инертных” (поверхностных и др.) групп, и протекание реакции затруднено.
Учитывая рассмотренные выше преимущества и недостатки обоих подходов, следует отметить, что в последнее время наблюдается тенденция использования комбинированного подхода, заключающегося в присоединении монодендронов, полученных конвергентным методом, не к точечному разветвляющему центру, а к дендримеру генерации 2 - 3, синтезированному заранее по дивергентной схеме (1).
Обратимся теперь к конкретным синтетическим примерам получения регулярных дендримеров.
1.1.2.1. Дивергентный подход.
К настоящему времени с помощью дивергентного подхода синтезированы дендримеры на основе полиамидоаминов (20), полиэтилениминов (20), углеводородов (иптицены) , полиэфиров , полиамидоспиртов (“арборолы”) (19), полиариламинов , полисилоксанов (3, ), поликарбосиланов (10, 11) и многие другие (1).
Остановимся подробнее на синтезе полисилоксанов и поликарбо-силанов, поскольку именно эти соединения, синтезированные в группе Музафарова А.М. (ИСПМ РАН) были взяты за основу для данной работы.
Полисилоксановые дендримеры получают по схеме, представленной на рисунке 10 (3, ). За основу здесь взята реакция взаимодействия силанолята натрия с хлорсиланом, протекающая количественно с образованием силоксановой связи. Для синтеза этих дендримеров используется трифункциональный разветвляющий центр (NC = 3) и мономеры АВ2 - типа (NB = 2). Получены регулярные структуры вплоть до генерации 8. Строение и индивидуальность конечных соединений доказаны методами ЯМР 1Н и 29Si-спектроскопии, гель-проникающей хроматографии.
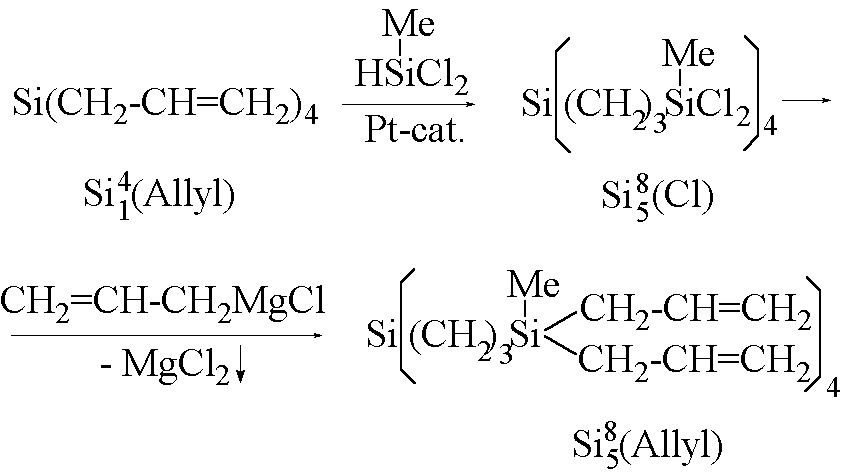
Рис. 11. Схема синтеза регулярных поликарбосилановых дендримеров (10).
Поликарбосилановые дендримеры получают по схеме, представленной на рисунке 11. Для синтеза таких систем может быть ди-, три- или тетрафункциональный разветвляющий центр и три- или тетрафункциональные мономеры (10). В данном случае в качестве исходного разветвляющего центра использован тетрааллилсилан, к которому по реакции гидросилилирования присоединяют метилдихлорсилан. Хлорсилильные группы впоследствии переводят в аллильные с помощью реактива Гриньяра - аллилмагнийхлорида. Эту последовательность повторяют несколько раз до получения дендримера необходимой генерации. К настоящему времени получены поликарбосилановые дендримеры с концевыми аллильными и винильными группами вплоть до 4 генерации. Строение и индивидуальность этих соединений доказаны методами ЯМР 1Н и 29Si-спектроскопии, гель-проникающей хроматографии.
1.1.2.2. Конвергентный подход.
Синтез дендримеров по этому методу был осуществлён только группами Фреше (26) и Нинана/Миллера (8, 27).
Этот подход был успешно использован для получения по крайне мере четырёх различных семейств дендримеров (1): полиарилэфиров, полиариленов, полиарилалкилов и поли(арил/азакраун)эфиров. Остановимся лишь на одном примере - синтезе полиарилэфирных дендримеров, предложенном Фреше (26).
На рисунке 12 показана схема получения тридендронов, содержащих 4, 10, 22 и 46 ароматических ядер полиариловых сложноэфирных дендримеров. Как видно из представленной схемы, выход конечного продукта с увеличением генерации с 1 по 4 падает с 98 до 25%. Это объясняется возрастанием стерических затруднений в фокальной точке монодендрона с увеличением размера макромолекулы.
1.2. Особенности физических свойств денримеров как следствие их необычной супрамолекулярной архитектуры
После рассмотрения строения и способов получения дендритных макромолекул естественно возникает вопрос: а как такая необычная супрамолекулярная архитектура денримеров отражается на их физических свойствах? Для ответа на этот вопрос обратимся к публикациям, посвящённым изучению физических свойств дендримеров.
В работе Морей с соавт. изучали физические свойства полиэфирных дендримеров, полученных на основе 3,5-дигидроксибензилового спирта. Исследовались как монодендроны, так и тридендроны генераций 0 ё 6 с молекулярной массой от 576 до 40689.
Хорошо известно, что для классических линейных полимеров, таких как, например, полистирол, с возрастанием молекулярной массы вязкость резко увеличивается в соответствии с уравнением Марка-Куна-Хаувинка (h)=KMa, где (h) - характеристическая вязкость полимера, М - средневесовая молекулярная масса, а К и a - константы для данного полимера. В отличие от почти всех других макромолекул, включая даже разветвлённые и звездообразные полимеры, дендримеры не подчиняются этому соотношению после достижения определённой молекулярной массы. В случае полиэфирных дендримеров, после достижения молекулярной массы порядка пяти тысяч дальнейшее её увеличение приводит к уменьшению характеристической вязкости, как показано для полиэфирного тридендрона на рисунке 13.
Это явление можно понять, если учесть, что с ростом номера генерации объём дендритной макромолекулы увеличивается пропорционально кубу линейного размера (V=4/3 pr3), в то время как её масса возрастает экспоненциально (~2G-1), что не выполняется ни для каких других полимеров.
Необычные соотношения между характеристической вязкостью и молекулярным весом для дендримеров коррелирует с изменением их формы от рыхлой к глобулярной структуре с увеличением молекулярной массы (2). Доказательство такого изменения формы приводится в работе . Здесь на примере монодендронов, к фокальной точке которых был присоединён сольватохромный зонд, изучалась зависимость максимума адсорбции lmax от номера генерации. При этом наблюдался излом кривой между генерациями 3 и 4, который соответствует переходу от рыхлой к глобулярной структуре. Интересно отметить, что этот переход происходит примерно при той же молекулярной массе, при которой наблюдается максимум характеристической вязкости. Такое поведение сольватохромного зонда также предполагает, что внутренняя часть дендритной макромолекулы представляет собой уникальное микроокружение. Фреше (2) предлагает его использовать для молекулярного катализа, систем доставки лекарств, искусственных ферментов и т.д.
В работе (32) на примере дендритных полиорганосилоксанов показано, что максимум имеется не только на кривой зависимости вязкости, но также и плотности и показателя преломления от номера генерации (рис. 14). Причём все эти максимумы для данных систем приходятся на одну и ту же шестую генерацию.
В отличие от нетипичного поведения дендримеров, описанного выше, термические свойства дендримеров хорошо коррелируют с их линейными аналогами (2). Например, изменение температуры стеклования в зависимости от молекулярного веса и количества концевых групп подчиняется модифицированной теории свободного объёма концов цепи (4). Совсем недавно вышла работа Х. Штуца , посвящённая температуре стеклования дендритных полимеров. В ней отмечается, что Tg денримеров является только функцией номера генерации дендритной ветви, но не зависит от количества этих ветвей, приходящихся на одну молекулу, и, следовательно, от молекулярного веса всей молекулы. Кроме того, в отличие от обычных полимеров, природа и количество концевых групп оказывает значительное влияние на температуру стеклования дендритных полимеров (4). Это происходит потому, что доля концевых групп не становится исчезающе мала на определённом этапе конверсии, как это происходит с обычными полимерами, а приближается к постоянному довольно значительному числу (і50 %). Следовательно, их химическая природа влияет на температуру стеклования. И, наконец, главный вывод этой работы: благодаря тому, что концевые группы и разветвления оказывают противоположное влияния на Tg и компенсируют друг друга в большой степени, разница между температурой стеклования линейных и дендритных полимеров оказывается незначительной.
Термогравиметрическое поведение дендритных полиэфиров в пределах экспериментальной ошибки не отличается от линейных полиэфиров (2).
Однако многие исследователи отмечают необычайно высокую растворимость денримеров по сравнению с их линейными аналогами. Так, Фреше (2) сравнивает растворимости дендритного полиэфира, полученного из 3,5-дигилроксибензойной кислоты (см. рис. 12) и его линейного аналога, полученного поликонденсацией монобензилового эфира этого мономера. Для сравнения брались образцы примерно одинаковой молекулярной массы (~11 тыс.) и, следовательно, содержащие одинаковое число мономерных единиц. В ТГФ растворимость дендримера составила 1.15 г/мл, в то время как растворимость линейного полиэфира составила 0.025 г/мл. Отличие почти на два порядка. Миллер и Нинан (8) отмечают ещё бульшую разницу в растворимости (порядка 105 раз) для дендритного полифенилена по сравнению с линейным полипарафениленом.
В работе (2) отмечается, что на растворимость сильно влияют как форма, так и функциональность (концевые группы) дендритной макромолекулы.
2. ЖК дендримеры как новый класс ЖК полимеров.
Экзотическое строение и свойства дендритных макромолекул в последнее время всё больше привлекает внимание исследователей, работающих в области полимерных жидких кристаллов (ЖК). Однако к настоящему времени опубликовано лишь несколько работ, посвящённых в основном синтезу ЖК дендримеров. Причём в литературе представлены результаты работ только двух групп учёных: под руководством Перчека (15, , ) и Рингсдорфа (16, ).
Первое сообщение о синтезе термотропных ЖК денримеров появилось в 1992 году. Перчек с соавт. (36) методом одностадийного неуправляемого синтеза, используя мономер А2В-типа, получили гиперразветвлённое соединение, обладающее ЖК свойствами (рис. 15). За основу был взят 10-бромо-1-(4-гидрокси-4'-бифенил)-2-(4-гидроксифенил)декан (TPD-b), являющийся мезогенным фрагментом благодаря конформационной изомерии . В процессе синтеза такого дендримера преимущественно реагируют молекулы мономера, находящиеся в гош-конформации, в то время как для образования нематического мезоморфного состояния необходим переход в анти-конформацию.
Как видно из представленной схемы, мезогенные группы в данном случае находятся не только на концах, но и во всём объёме дендритной молекулы. Такое строение описываемых соединений во многом напоминает ЖК полимеры с мезогенными группами в основной цепи. Поэтому авторы в работе (15) пытаются сравнить свойства этих ЖК денримеров со свойствами их линейных полимерных аналогов. Прежде всего, они отмечают относительно низкую молекулярную массу (от 4400 до 7900) и широкое молекулярно-массовое распределение (порядка 2.6 ё 3.9) полученных ЖК дендримеров по сравнению с их линейными
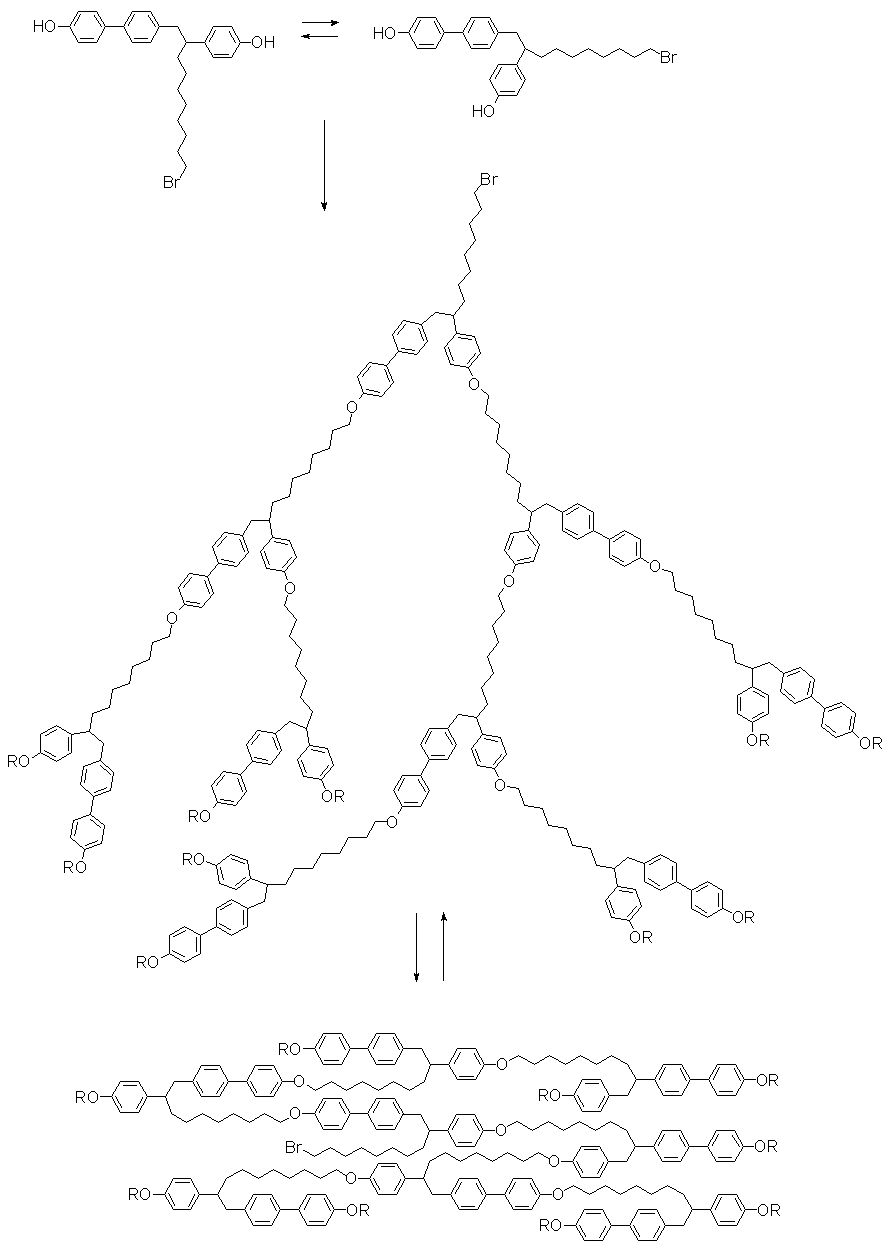
Рис. 15. Полимеризация TPD-b и схематическое представление перехода между нематической и изотропной фазой ЖК дендримера Перчека (15).
аналогами, синтезированными по той же реакции (в них Mw = 29000 ё 41000 и Mw/Mn ” 1.6 ё 2.0). К одной из гипотез образования низкомолекулярных гиперразветвлённых жидких кристаллов авторы относят возможность внутримолекулярной циклизации, вполне вероятной при такой схеме синтеза. Сравнивая ЖК свойства, авторы делают вывод, что хотя дендримеры и обладают нематической мезофазой, так же как и их линейные аналоги, порядок в этой мезофазе ниже, чем в линейных ЖК полимерах. Это заключение основывается на данных ДСК, показывающих, что энтальпия перехода из нематической мезофазы в изотропный расплав у ЖК дендримера более чем в два раза меньше, чем у его линейного полимерного аналога. Следует отметить довольно узкий интервал существования ЖК мезофазы у данного дендримера (20 ё 40 °С), который практически совпадает с его линейным аналогом.
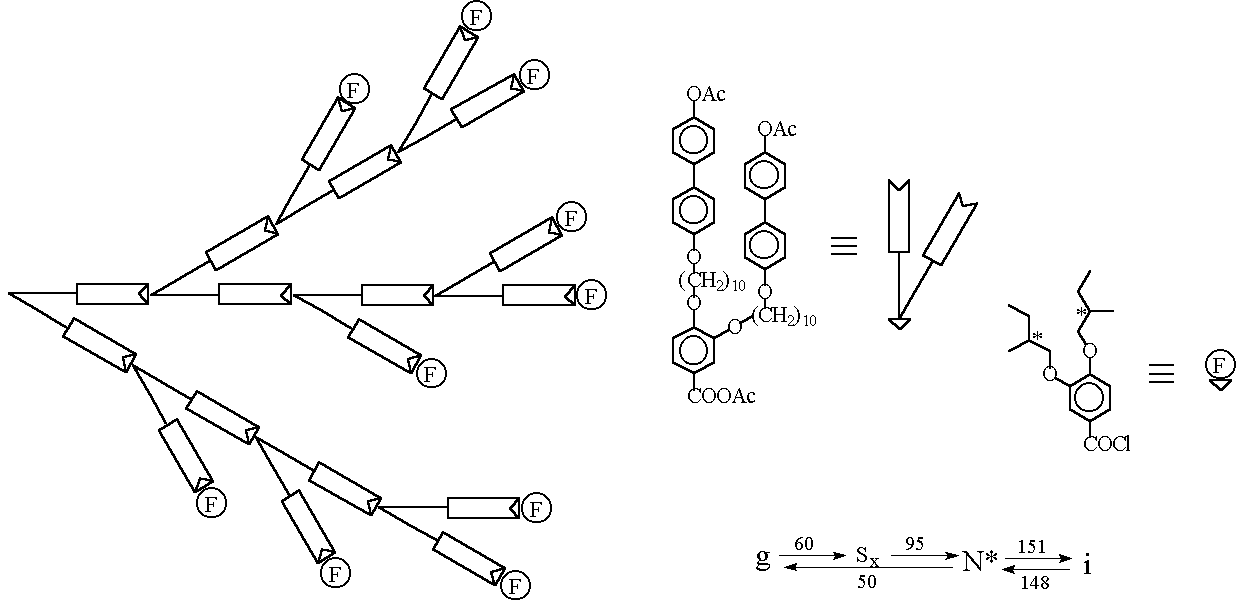
Рис. 16. Схематическое изображение и фазовые переходы ЖК дендримера Рингсдорфа (31).
Вторая группа исследователей под руководством профессора Рингсдорфа получила гиперразветвлённый ЖК полимер сходного строения (16, 38) (рис. 16). Синтезированный ЖК дендример также имел довольно низкую молекулярную массу (Mn=6500) и широкое молекулярно-массовое распределение (Mw/Mn = 3.1). Принципиальное отличие данного ЖК дендримера от вышеописанного заключается в том, что к непрореагировавшим в результате неуправляемого синтеза концевым группам дендримера присоединили хиральные фрагменты. В результате полученный ЖК дендример обладает холестерической мезофазой. Кроме того, данный дендример обладает широким температурным интервалом существования ЖК мезофазы (95 ё 150 °С), в отличие от дендримера Перчека.
Рингсдорф также сообщает о синтезе мономера АВ2 -типа (рис. 17), который образует гиперразветвлённые ЖК системы благодаря водородным связям (31). Однако об изучении ЖК свойств таких систем в литературе не сообщается.
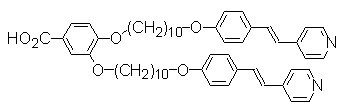
Рис. 17. АВ2-мономер, образующий гиперразветвлённые ЖК системы через водородные связи (32).
Обобщая литературные данные, следует отметить, что к настоящему времени опубликованы лишь первые работы, сообщающие о синтезе ЖК дендримеров, основанном на неуправляемом подходе. Получены только нерегулярные ЖК системы, содержащие мезогенные группы во всём объёме дендритной макромолекулы и этим напоминающие ЖК полимеры с мезогенными группами в основной цепи.
В настоящее время группой немецких исследователей ведутся работы по синтезу регулярных ЖК дендримеров методом управляемого синтеза, однако их результаты ещё не опубликованы. Поэтому данная работа и вышедшая по ней публикация (14) претендует на первенство в области синтеза регулярных ЖК дендримеров с концевыми мезогенными группами.
Синтез ЖК дендримеров
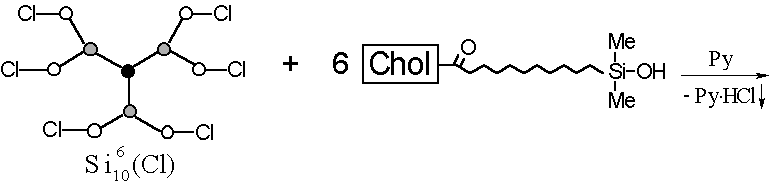
1.1. Метилсилоксановый дендример с концевыми холестеринсодержащими мезогенными группами.
На первом этапе данной работы необходимо было решить вопрос: можно ли в принципе получить дендример регулярного строения с концевыми мезогенными группами, и если да, то будет ли полученное вещество обладать ЖК свойствами. Для этого за основу была выбрана дендритная полиметилхлорсилоксановая матрица следующего строения:
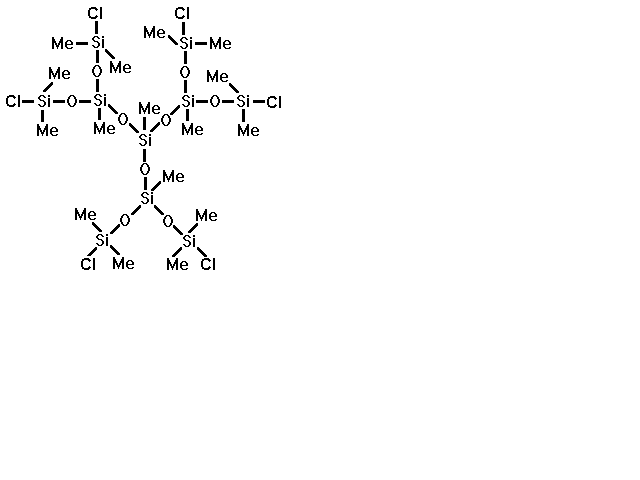
Рис.18. Исходная дендритная полиметилхлорсилоксановая матрица
Подробная методика синтеза этого соединения описана в работе (14). Основные критерии, по которым осуществлялся выбор исходной силоксановой матрицы, заключались в синтетической доступности, простоте анализа и возможности ее выделения в индивидуальном состоянии. В рамках разработанной ранее () методологии синтеза дендритных полиоргано-силоксанов, а также имеющихся в наличии методов анализа и выделения соединение вполне отвечает перечисленным выше критериям.
Выбранная дендритная матрица содержала концевые активные хлорсилильные группы. Для того, чтобы присоединить к ней мезогенные группы, их нужно было модифицировать таким образом, чтобы они содержали концевую группу, способную количественно заместить Si-Cl - группы выбранного дендримера с образованием стабильной связи. Силанольная группа Si-OH вполне удовлетворяет этим требованиям: она количественно реагирует с Si-Cl - группами с образованием прочной силоксановой связи. Кроме того, учитывая опыт по синтезу ЖК полимеров с мезогенными группами в боковых ответвлениях, где в качестве полимерной “матрицы” используются гребнеобразные полимеры, следует отметить, что если мезогенные группы присоединены к полимерной основе напрямую, то такие полимеры , как правило, не проявляют ЖК свойств (). Для реализации ЖК состояния в полимерах необходимо, чтобы жёсткие мезогенные группы были присоединены к основной цепи через гибкую алифатическую или другую развязку (“спейсор”). Причём ЖК свойства полимеров существенно зависят от длины этого спейсора (, ).
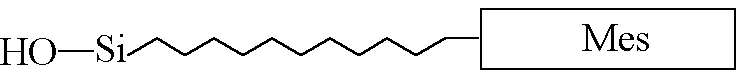
Рис.19. Схематическое изображение модифицированной мезогенной группы.
Исходя из вышесказанного, мезогенсодержащий фрагмент для “прививки” к полиметилхлорсилоксановой дендритной матрице в нашем случае должен состоять из следующих основных структурных единиц (рис. 19): мезогенной группы и алифатической развязки, содержащей концевую группу Si-OH, способную реагировать с концевыми хлорсилильными группами дендритной матрицы с образованием целевого продукта - ЖК дендримера.
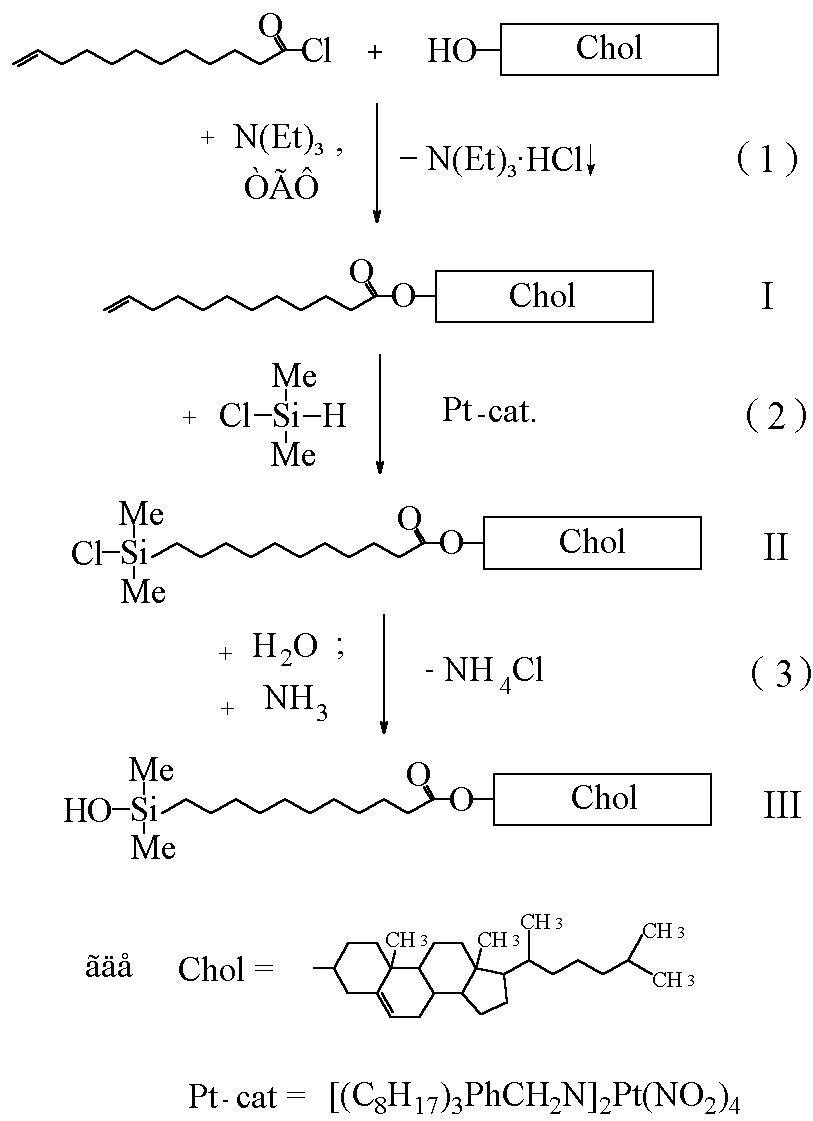
Рис.20. Схема синтеза холестеринсодержащей мезогенной группы.
В качестве мезогенной была выбрана холестериновая группа ввиду её доступности и широкого использования для синтеза гребнеобразных ЖК-полимеров. Выбор ундециленатного спейсора определялся теми же критериями.
Модификация холестериновой мезогенной группы проводилась по схеме, представленной на рис. 20.
Синтез соединения III включает в себя три химические стадии (схемы (1), (2) и (3)). Холестериновый эфир 10-ундециленовой кислоты I, был получен по стандартной методике ацилированием холестерина хлорангидридом 10-ундециленовой кислоты (схема (2)), температуры фазовых переходов совпадают с литературными данными ().
Соединение II было получено гидросилилированием эфира I в среде сухого ТГФ в присутствии трехкратного избытка диметилхлорсилана. В качестве катализатора использовали бис-(триоктилбензиламин)-тетранитрито-платину (схема (3)). Завершенность реакции контролировали методом ИК-спектроскопии (рис. 21) по исчезновению полосы валентных колебаний терминальной двойной углерод-углеродной связи в молекулах соединения I в области 1640 см-1. Одновременно наблюдали появление полосы поглощения в области 1260 см-1, соответствующей валентным колебаниям связи Si-CH3.
В спектре ПМР (Таблица 1.) образовавшегося холестеринового эфира 11-(диметилхлорсилил)-ундекановой кислоты II в отличие от исходного эфира I отсутствуют сигналы протонов, расположенных при терминальной двойной углерод-углеродной связи (дублет 1=5.2 м.д. и мультиплет 2=6.0 м.д.), что также свидетельствует о полноте протекания реакции гидросилилирования. Вместе с тем в спектре ПМР соединения II, как и в спектре соединения I, присутствуют характерные сигналы протона (3) при карбоксильной группе (мультиплет:3=4.8 м.д.) и протона (4) при двойной углерод-углеродной связи (синглет:4=5.7 м.д.) в стероидном ядре холестерила. При этом соотношение интегральных интенсивностей сигналов протонов (3) и (4) соответствует расчетному значению 1:1. Синглетный сигнал протонов метильных радикалов у атомов кремния в спектре ПМР соединения II проявляется в области =0.1 м.д. Соотношение интегральных интенсивностей сигналов протонов метильных радикалов у атомов кремния и сигналов протонов (3), (4) также соответствует расчетному значению 6:1.
Функциональный анализ показал, что содержание хлора в полученном соединении II составляет 5.75% (расчетное значение 5.6%). Перечисленные выше данные свидетельствуют о том, что реакция гидросилилирования (схема (3)) протекает достаточно селективно по концевой двойной связи эфира I, не затрагивая двойную связь в стероидном ядре холестерина.
Гидролиз соединения II проводили в 1%-ном эфирном растворе избытком воды при 0oС, в присутствии аммиака в качестве акцептора выделяющегося HCl. Приведенные условия позволяют практически исключить протекание в реакционной системе нежелательных конденсационных процессов, приводящих к димеризации образующегося силанола III.
В ИК-спектрах силанола III наблюдается широкая полоса поглощения валентных колебаний ассоциированных гидроксильных групп у атомов кремния в области 3960 см-1.
"Прививку" холестеринсодержащих мезогенных групп к силоксановой матрице осуществляли гетерофункциональной конденсацией между и соединением III в присутствии пиридина в качестве акцептора выделяющегося HCl (рис. 22). Полученное целевое соединение IV очищали переосаждением из раствора в ТГФ этанолом. Конечный продукт представляет собой бесцветное воскообразное вещество.
Подобные работы: