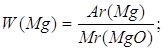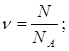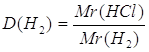Решение задач по химии
Решебник
разноуровневых заданий
по химии
для дифференцированного контроля
знаний учеников
8 класс
г. Кривой Рог
2001 год
Вариант 1
Задачи
Первый уровень
1.
Дано: О2 | 1. Определяем относительную плотность
| |
Д(Н2) — ? | ||
| Ответ: | относительная плотность кислорода по водороду 16. | |
2.
Дано: Н2О | 1. Определяем массовую долю оксигена в воде
| |
| W(O) — ? | ||
| Ответ: | массовая доля оксигена в воде 87%. | |
3. О2 – молекула простого вещества – кислорода, состоящая из двух атомов оксигена.
2О2 – две молекулы простого вещества, каждая из которых состоит из двух атомов оксигена.
О – один атом оксигена.
10Н2О – десять молекул сложного вещества, каждая из которых состоит из двух атомов гидрогена и одного атома оксигена.
4СО2 – четыре молекулы сложного вещества, каждая из которых состоит из одного атома карбона и двух атомов оксигена.
4. HNO3
Второй уровень
5.
Дано: ν(N2)=5 моль |
1. Определяем число молекул азота
2. Определяем число атомов нитрогена
| |
N(N2) — ? N(N) — ? | ||
| Ответ: | в 5 моль азота содержится 30∙1023 молекул азота и 60∙1023 атомов нитрогена. | |
6.
Дано: m(Cu)=16 кг | х 16кг CuO + H2 = Cu + H2O 1 кмоль 1 кмоль 80кг/моль 64кг/моль 80кг 64кг 1. Определяем массу купрум (II) оксида х:80кг=16кг:64кг
| ||
| m(CuO) — ? |
| ||
| Ответ: | для получения 16кг меди надо взять 20кг купрум (II) оксида. |
| |
| |||
7.
Дано: V(H2)=16л | 2H2+O2=2H2O 1. Определяем объем кислорода V(H2):V(O2)=2:1=16л:х
| |
V(O2) — ? | ||
| Ответ: | на полное сгорание 16 литров водорода пойдет 8л кислорода. | |
Третий уровень
8. 2Ca+O2=2CaO
CaO+H2O=Ca(OH)2
Ca(OH)2+2HCl=CaCl2+2H2O
9.
Дано: Д(О2)=1,5 | 1. Определяем относительную молекулярную массу озона
Mr(озона)=Д(О2)∙Mr(O2) Mr(озона)=1,5∙32=48 2. Определяем формулу озона 16 – 1 атом 48 – х атомов
| |
Формула озона — ? | ||
| Ответ: | формула озона – О3. | |
10. При увеличении давления химическое равновесие сместится в сторону образования водорода и кислорода.
Вариант 2
Задачи
Первый уровень
1.
Дано: CaCO3 |
1. Определяем массовую долю кальция
| |
| W(Ca) — ? | ||
| Ответ: | массовая доля кальция в кальций карбонате 40%. | |
2.
Дано: N(H2)=24∙1023 молекул | 1. Определяем количество вещества водорода
| |
ν(H2) — ? | ||
| Ответ: | количество вещества водорода – 4моль. | |
3.
Дано: Д(Н2)=8 | 1. Определяем Mr(в-ва)
Mr(в-ва)=Д(Н2)∙Mr(H2) Mr(в-ва)=8∙2=16 | |
| Mr(в-ва) — ? | ||
| Ответ: | относительная молекулярная масса вещества – 16. | |
4 2Br – два атома брома
Br – один атом брома
3HBr – три молекулы сложного вещества, каждая из которых
Второй уровень
5.
Дано: ν(AgNO3)=3моль | 3моль хг AgNO3 + NaCl = AgCl + NaNO3 1моль 1моль 143,5г/моль 143,5г 1. Определяем массу аргентум хлорида 3моль:1моль=х:143,5г
| |
| m(AgCl) — ? | ||
| Ответ: | масса аргентум хлорида 430,5г. | |
6.
Дано: S V(O2)=44,8л | 44,8лх S + O2 = SO2 1моль 1моль 22,4л/моль 22,4л/моль 22,4л 22,4л 1. Определяем объем сульфур (IV) оксида 44,8л:22,4л=х:22,4л
| |
V(SO2) — ? | ||
| Ответ: | объем сульфур (IV) оксида – 44,8л. | |
7. С повышением температуры химическое равновесие сместится в сторону исходных веществ.
Третий уровень
8. 2Pb+O2=2PbO
PbO+2HCl=PbCl2+H2O
PbCl2+2AgNO3=Pb(NO3)2+2AgCl↓
9. а) CuO+2HNO3=Cu(NO3)2+H2O
10.
Дано: m(H2SO4)=4,9г NaOH | 4,9гхг 2NaOH + H2SO4 = Na2SO4 + 2H2O 1моль 1моль 98г/моль 142г/моль 98г 142г 1. Определяем массу натрий сульфата 4,9г:98г=х:142г
| |
m(Na2SO4) — ? | ||
| Ответ: | в результате взаимодействия 4,9г сульфатной кислоты с натрий гидроксидом образуется 7,1г натрий сульфата. | |
Вариант 3
Задачи
Первый уровень
1.
Дано: CuSO4 | 1. Определяем массовую долю купрума
| |
| W(Cu) — ? | ||
| Ответ: | массовая доля купрума в купрум (II) сульфате – 40% | |
2.
Дано: ν(О2)=3моль | 1. Определяем число молекул кислорода
N=3моль∙6∙1023молекул/моль=18∙1023молекул | |
N(O2) — ? | ||
| Ответ: | в 3 моль кислорода содержится 18∙1023молекул. | |
3. N2 – одна молекула простого вещества азота каждая из которых состоит из двух атомов нитрогена.
5N – пять атомов нитрогена.
N2O – одна молекула сложного вещества, состоящая из двух атомов нитрогена и одного атома оксигена.
4HNO3 – четыре молекулы сложного вещества, каждая из которых состоит из одного атома гидрогена, одного атома нитрогена и трех атомов оксигена.
7H2 – семь молекул простого вещества водорода, каждая из которых состоит из двух атомов гидрогена.
4.
Дано: ν(Н2)=2моль | 1. Определяем объем водорода
V(H2)=2моль∙22,4л/моль=44,8л | |
V(H2) — ? | ||
| Ответ: | объем 2 моль водорода составляет 44,8л. | |
Второй уровень
5.
Дано: υ(NaOH)=4моль | 4мольхг 2NaOH + H2SO4 = Na2SO4 + 2H2O 2моль 1моль 98г/моль 98г 1. Определяем массу сульфатной кислоты 4моль:2моль=х:98г
| |
m(H2SO4) — ? | ||
| Ответ: | на нейтрализацию 4 моль натрий гидроксида пойдет 196г сульфатной кислоты. | |
6.
Дано: m(CuO)=16г | хг 16г 2Cu + O2 = 2CuO 2моль 2моль 64г/моль 80г/моль 64г 160г | |
| m(Cu) — ? | ||
1. Определяем массу меди х:64г=16г:160г
| ||
| Ответ: | для получения 16г купрум (II) оксида надо взять 6,4г меди. | |
7. С повышением температуры равновесие сместится в сторону исходных веществ.
Третий уровень
8. 2Cu+O2=2CuO
CuO+2HCl=CuCl2+H2O
CuCl2+2NaOH=Cu(OH)2↓+2NaCl
9. а) Fe(OH)2+H2SO4=FeSO4+2H2O
10.
Дано: Д(Н2)=16 | 1. Определяем относительную молекулярную массу кислорода.
Mr=16∙2=322. Определяем формулу
| |
| Формула — ? | ||
| Ответ: | О2. | |
Вариант 4
Задачи
Первый уровень
1.
Дано: Fe2O3 | 1. Определяем массовую долю феррума
| |
| W(Fe) — ? | ||
| Ответ: | массовая доля феррума в феррум (III) оксиде – 70%. | |
2.
Дано: О2 | 1. Определяем относительную плотность кислорода по водороду
| |
Д(Н2) — ? | ||
| Ответ: | относительная плотность кислорода по водороду – 16. | |
3. 7Н2О – семь молекул сложного вещества, каждая из которых состоит из двух атомов гидрогена и одного атома оксигена.
Н2 – молекула простого вещества, состоящая из двух атомов гидрогена.
5MgO – пять молекул сложного вещества, каждая из которых состоит из одного атома магния и одного атома оксигена.
4Cu – четыре атома купрума.
3О – три атома оксигена.
4. При уменьшении температуры химическое равновесие сместится в сторону продуктов реакции.
Второй уровень
5.
Дано: m(Al)=10,8г | 1. Определяем количество атомов алюминия
| |
| N(Al) — ? | ||
| Ответ: | в 10,8г алюминия содержится 1,2∙1023 молекул. | |
6.
Дано: V(H2)=6,72л | х 6,72л FeO + H2 = Fe + H2O 1моль 1моль 72г/моль 22,4л/моль 72г 22,4л 1. Определяем массу феррум (II) оксида х:72г=6,72л:22,4л
| |
| m(FeO) — ? | ||
| Ответ: | масса феррум (II) оксида – 21,6г. | |
7. б) AlCl3+3NaOH=Al(OH)3↓+3NaCl
Третий уровень
8. а) Pb(NO3)2+K2S=PbS↓+2KNO3
9. Zn+2HCl=ZnCl2+H2
ZnCl2+2NaOH=Zn(OH)2↓+2NaCl
Zn(OH)2+H2SO4=ZnSO4+2H2O
10.
Дано: ν(SO2)=1,5моль | SO2+O2=SO3 SO3+H2O=H2SO4 1,5 мольхг SO2 → H2SO4 1моль 1моль 98г/моль 98г 1. Определяем массу сульфатной кислоты 1,5моль:1моль=х:98г
| |
m(H2SO4) — ? | ||
| Ответ: | 1,5 моль сульфур (IV) оксида пойдет на образование 147г сульфатной кислоты. | |
Вариант 5
Задачи
Первый уровень
1.
Дано: CaCO3 | 1. Определяем массовую долю кальция в кальций карбонате
| |
| W(Ca) — ? | ||
| Ответ: | массовая доля кальция в кальций карбонате – 40%. | |
2.
Дано: N(CO2)=36∙1028 | 1. Определяем количество вещества карбон (IV) оксида
| |
ν(CO2) — ? | ||
| Ответ: | количество вещества карбон (IV) оксида – 6 моль. | |
3.
Дано: Д(Н2)=8 | 1. Определяем относительную молекулярную массу метана
| |
| Mr(метана) — ? | ||
| Ответ: | относительная молекулярная масса метана – 16. | |
4. Уменьшение концентрации исходных веществ вызывает смещение химического равновесия в сторону исходных веществ, т.е. СО и О2.
Второй уровень
5.
Дано: m(Cu)=128г | хг 128г CuO + H2 = Cu + H2O 1моль 1моль 80г/моль 64г/моль 80г 64г 1. Определяем массу купрум (II) оксида х:80г=128г:64г
| |
| m(CuO) — ? | ||
| Ответ: | в реакцию может вступить 160г купрум (II) оксида для получения 128г меди. | |
6. б) Na2CO3+2HNO3=2NaNO3+H2O+CO2
7.
Дано: m(Fe)=28г m(O)=12г m(Fe2O3)=40г | 1. Определяем массовую долю феррума
2. Определяем массовую долю оксигена
| |
W(Fe) — ? W(O) — ? | ||
| Ответ: | в феррум (III) оксиде массовая доля феррума – 70%, массовая доля оксигена – 30%. | |
Третий уровень
8. Si+O2=SiO2
2W+3O2=2WO3
4As+3O2=2As2O3
Os+2O2=OsO4
9. N2+O2=2NO
2NO+O2=2NO2
4NO2+2H2O+O2=4HNO3
NaOH+HNO3=NaNO3+H2O
10.
Дано: N:O=7:16 | N:O=7:16 N:O=14:32 число атомов нитрогена – 1, оксигена – 2, отсюда – NO2 | |
| Формула — ? | ||
| Ответ: | формула соединения – NO2. | |
Вариант 6
Задачи
Первый уровень
1.
Дано: CuSO4 | 1. Определяем массовую долю купрума в купрум (II) оксиде
| |
| W(Cu) — ? | ||
| Ответ: | массовая доля купрума – 40%. | |
2. Н2 – два атома гидрогена
3Fe – три атома феррума
2NaOH – две молекулы сложного вещества, каждая из которых состоит из одного атома натрия, одного атома оксигена и одного атома нитрогена.
3.
Дано: H2S | 1. Определяем относительную плотность сероводорода по водороду
| |
Д(Н2) — ? | ||
| Ответ: | относительная плотность сероводорода по водороду – 17. | |
4. Повышение давления смещает химическое равновесие в сторону образования карбон (IV) оксида, а понижение давления – в сторону исходных веществ, т.е. СО и О2.
Второй уровень
5.
Дано: m(O2)=8г | 1. Определяем объем кислорода
| |
V(O2) — ? | ||
| Ответ: | объем 8г кислорода – 5,6л. | |
6.
Дано: m(CuO)=320г | 320гхг CuO + 2HNO3 = Cu(NO3)2 + H2O 1моль 2моль 80г/моль 63г/моль 80г 63г 1. Определяем массу нитратной кислоты 320г:80г=х:63г
| |
m(HNO3) — ? | ||
| Ответ: | на растворение 320г купрум (II) оксида пойдет 252г нитратной кислоты. | |
7. BaCl2+2AgNO3=Ba(NO3)2+2AgCl↓
Третий уровень
8. 2Mg+O2=2MgO
MgO+2HCl=MgCl2+H2O
MgCl2+2AgNO3=Mg(NO3)2+2AgCl↓
Mg(NO3)2+Na2CO3=MgCO3+2NaNO3
9.
Дано: υ(CaCO3)=20моль HNO3 | 20мольхл CaCO3 + HNO3=Ca(NO3)2+H2O+ CO2 1моль 1моль 22,4л/моль 22,4л 1. Определяем объем карбон (IV) оксида 20моль:1моль=х:22,4л
| |
V(CO2) — ? | ||
| Ответ: | объем газа 448л. | |
10.
Дано: С:Н=3:1 | 1. Определяем формулу вещества. С:Н=3:1С:Н=12:4 число атомов карбона – 1, гидрогена – 4 формула СН4 | |
| Формула — ? | ||
| Ответ: | формула соединения СН4. | |
Вариант 7
Задачи
Первый уровень
1. 2Fe – два атома феррума.
2Р2О5 – две молекулы сложного вещества, каждая из которых состоит из двух атомов фосфора и пяти атомов оксигена.
4О2 – четыре молекулы простого вещества – кислорода, каждая из которых состоит из двух атомов оксигена.
S – один атом сульфура.
CuSO4 – одна молекула сложного вещества, которая состоит из одного атома купрума, одного атома сульфура и четырех атомов оксигена.
2.
Дано: m(CO2)=8,8г | 1. Определяем число молекул карбон (IV) оксида
| |
N(CO2) — ? | ||
| Ответ: | в 8,8 г карбон (IV) оксида содержится 1,2∙1023 молекул. | |
3.
Дано: СО2 | 1. Определяем относительную плотность по водороду
| |
Д(Н2) — ? | ||
| Ответ: | относительная плотность карбон (IV) оксида по водороду – 22. | |
4. Увеличение концентрации кислорода сместит химическое равновесие в сторону образования продукта реакции.
5.
Дано: ν(Mg)=5моль HCl | 5моль хл Mg + 2HCl = MgCl2 + H2 1моль 1моль 22,4л/моль 22,4л 1. Определяем объём водорода 5 моль: 1 моль = х : 22,4 л
| |
V(H2) — ? | ||
| Ответ: | объём водорода, который выделяется при действии хлоридной кислоты на 5 моль магния, равен 112 л. | |
6. SO2 + H2O = H2SO3
NaOH + SO2 = Na2SO3 + H2O
7.
Дано: m (NaOH) = 40 г H2SO4 | 40 г х г 2 NaOH + H2SO4 = Na2SO4 + 2H2O 2 моль 1 моль 40 г/моль 142 г/моль 80 г 142 г 1. Определяем массу натрий сульфата 40 г : 80 г = х : 142 г
| |
m (Na2SO4) — ? | ||
| Ответ: | при действии сульфатной кислоты на 40 г натрий гидроксида образуется 71 г натрий сульфата. | |
Третий уровень
8. 2 Na + 2H2O = 2NaOH + H2
2NaOH + H2SO4 = Na2SO4 + 2H2O
Na2SO4 + BaCl = BaSO4¯ + 2NaCl
NaCl + AgNO3 = NaNO3 + AgCl¯
9.
Дано: n (NaOH) = 3 моль Сl(NO3)3 | 3 моль х г Сl(NO3)3 + 3 NaOH = Cl(OH)3¯ + 3NaNO3 3 моль 1 моль 103 г/моль 103 г 1. Определяем массу хром (3) гидроксида 3 моль: 3 моль = х : 109 г
| |
m (Cl(OH)3) — ? | ||
| Ответ: | в результате действия 3 моль натрий гидроксида на хром (III) нитрат образуется 103 г хром (III) гидроксида. | |
10. 1) 3Mg + 2H3PO4 = Mg3(PO4)2 + 3H2
2) 3MgO + 2H3PO4 = Mg3(PO4)2 + 3H2O
3) 3Mg(OH)2+ 2H3PO4 = Mg3(PO4)2 + 6H2O
Вариант 8
Задачи
Первый уровень
1.
Дано: SO3 | 1. Определяем массовую долю сульфура
| |
| W(S) — ? | ||
| Ответ: | массовая доля сульфура в сульфур (VI) оксиде 40% | |
2.
Дано: m (H2SO4) = 392 г | Определяем количество вещества сульфатной кислоты
| |
n(H2SO4) — ? | ||
| Ответ: | 4 моль сульфатной кислоты | |
3.
Дано: C3H8 | Определяем относительную плотность пропана по водороду
| |
D(H2) — ? | ||
| Ответ: | относительная плотность пропана по водороду 22 | |
4. Повышение температуры будет способствовать смещению равновесия в сторону исходных веществ
Второй уровень
5.
Дано: m (CuO) = 16 г | 16 г х л CuO + H2= Cu + H2 1 моль 1моль 80 г/моль 22,4 л/моль 80 г 22,4 л 1. Определяем объём водорода 16 г : 80 г = х : 22,4 л
| |
V (H2) — ? | ||
| Ответ: | объём водорода, необходимый для восстановления 16 г купрум (2) оксида 4,48 л | |
6. а) Ca(NO3)2+Na2CO3 = CaCO3¯ + 2NaNO3
7.
Дано: n (Na) = 1,5 моль H2O, н.у. | 1,5 моль х л 2Na+ 2H2O = 2NaOH + H2 2моль 1 моль 22,4 л/моль 22,4 л 1. Определяем объём водорода 1,5 моль : 2 моль = х : 22,4 л
| |
V(H2) — ? | ||
| Ответ: | в результате действия воды на 1,5 моль натрия выделилось 33,6 л водорода | |
Третий уровень
8. 2Na +2HOH = 2NaOH + H2
Na2O + H2O = 2NaOH
9. Ba + 2H2O = Ba(OH)2 +H2
Ba(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O
Ba(NO3)2 +Na2CO3 = BaCO3¯ + 2NaNO3
BaCO3 + 2HNO3 = Ba(NO3)2 + H2O + CO2
10.
Дано: C:O = 3:8 | C:O = 3:8 C:O = 12:32 число атомов С – 1 число атомов О –2, отсюда СО2 | |
| формула — ? | ||
| Ответ: | СО2 | |
Вариант 9
Задачи
Первый уровень
1.
Дано: C2H6 | 1. Определяем относительную плотность этана по водороду
| |
D(H2) - ? | ||
| Ответ: | относительная плотность этана по водороду 15 | |
2.
Дано: n (N2) = 2 моль | 1. Определяем число молекул азота в 2 моль азота
N(N2) = 2 моль∙6∙1023молекул/моль = 12∙1023 молекул 2. Определяем число атомов нитрогена 1 молекула азота N2 сод. 2 атома нитрогена 12∙1023 молекул — х
| |
N(N2) - ? N(N) — ? | ||
| Ответ: | азот количеством вещества 2 моль содержит 12∙1023 молекул азота и 24∙1023 атомов нитрогена. | |
3.
Дано: n (О2) = 2 моль | 1. Определяем объём 2 моль кислорода
V(O2) = 2 моль∙22,4 л/моль = 44,8 л | |
V(O2) — ? | ||
| Ответ: | занимают объём 44,8 л | |
4. При понижении температуры химическое равновесие сместится в сторону исходного вещества, т.е. HBr
Второй уровень
5.
Дано: n (HNO3) = 2 моль KOH | 2 моль х г KOH + HNO3 = KNO3 + H2O 1 моль 1 моль 101 г/моль 101 г 1. Определяем массу калий нитрата 2 моль : 1 моль = х : 101 г
| |
m (KNO3) — ? | ||
| Ответ: | в результате нейтрализации едкого калия 2 моль нитратной кислоты образовалось 202 г калий нитрата. | |
6. а) AlCl3 + 3AgNO3 = Al(NO3)3 + 3AgCl¯
7.
Дано: n (Ca(OH)2) = 2 моль | x 2 моль Ca + 2HOH = Ca(OH)2 + H2 1 моль 1 моль 1. Определяем количество вещества кальция х : 1 моль = 2 моль : 1 моль
| |
| n (Ca) — ? | ||
| Ответ: | для получения 2 моль кальций гидроксида в реакцию с водой должно вступить 2 моль кальция | |
Третий уровень
8. 1) Сu + Cl2 = CuCl2
2) CuO + 2HCl = CuCl2 + H2O
3) Cu(OH)2 + 2HCl = CuCl2 + 2H2O
9. 1) 2Ca + O2 = 2CaO
2) CaO + H2O = Ca(OH)2
3) Ca(OH)2 + 2HCl = CaCl2+ 2H2O
4) CaCl2+Na2SO4 = CaSO4¯ + 2NaCl
10.
Дано: m (Zn и Ag) = 10 г V (H2) = 1,12 л | x г 1,12 л Zn + 2HCl = ZnCl2 + H2 1 моль 1 моль 65 г/моль 22,4 л/моль 65 г 22,4 л 1. Определяем массу цинка х : 65 г = 1,12 л : 22,4 л
2. Определяем массовую долю цинка в смеси
3. Определяем массовую долю серебра в смеси 100% - 32,5% = 67,5% | |
W (Zn) — ? W (Ag) — ? | ||
| Ответ: | смесь состоит из 32,5% цинка и 67,5% серебра | |
Вариант 10
Задачи
Первый уровень
1.
Дано: MgO | 1. Определяем массовую долю магния в оксиде магния
| |
| W(Mg) — ? | ||
| Ответ: | массовая доля магния в оксида магния 60%. | |
2.
Дано: n (H2O) = 3 моль | 1. Определяем число молекул воды в 3 моль воды
N(H2O) = 3 моль∙6∙1023 молекул/моль=18∙1023молекул | |
N(H2O) — ? | ||
| Ответ: | в 3 моль воды содержится 18∙1023 молекул. | |
3.
Дано: HCl | Определяем относительную плотность хлороводорода по водороду
| |
D(H2) - ? | ||
| Ответ: | относительная плотность хлороводорода по водороду 18,25. | |
4. При повышении давления химическое равновесие сместится в сторону образования аммиака NH3.
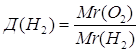
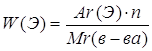
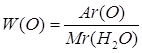
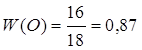 или 87%
или 87%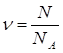
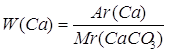
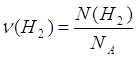
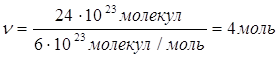
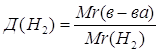
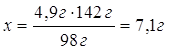
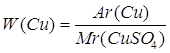
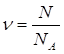 ;
;  ;
; 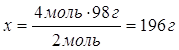
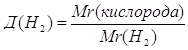
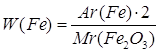
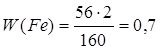 или 70%
или 70%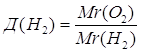
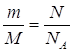 ;
; 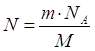
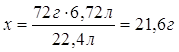
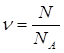
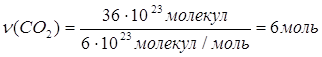
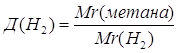 ;
; 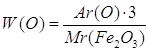
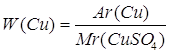
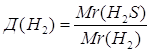
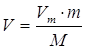
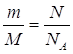 ;
; 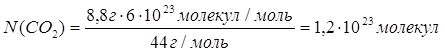
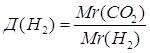
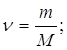
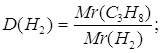
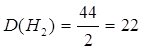
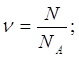
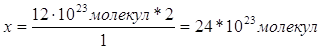
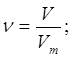
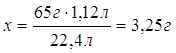
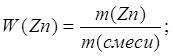
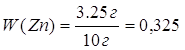 или 32,5 %
или 32,5 %