Кинетическая модель механизма компенсированного распада углеводородов на платине
О.А. Реутова, Э.В. Захаров, Омский государственный университет, кафедра аналитической химии и химии нефти
1. Введение
Исследования химии углерода получили в последние годы мощный импульс в связи с открытиями в области материаловедения. А c точки зрения катализа до сих пор остаются актуальными проблемы понимания механизмов реакций, связанных с переработкой углеводородного сырья, дезактивации и регенерации катализаторов вследствие процессов коксообразования. Само понятие кокса было сформулировано достаточно давно и означает, по существу, отложения на поверхности катализаторов углеродистых структур, механизм образования которых до сих пор точно не установлен.
В настоящее время в литературе широко представлены экспериментальные данные по различным механизмам коксоотложения, тем не менее, достаточно полные и убедительные кинетические модели этих процессов отсутствуют. В первую очередь, это относится к модели отложения углерода на активном компоненте - платине. При этом разработка модели коксообразования на монокристалле платины дает ключ к пониманию механизмов дезактивации нанесенных Pt - содержащих катализаторов риформинга, поскольку механизм коксоотложения на металлическом компоненте является частью более сложной модели закоксования системы "металл - носитель".
В настоящее время известно несколько механизмов коксообразования:
схема консекутивных реакций, по которой образуются слоистые отложения, например, на носителе катализаторов риформинга - окиси алюминия (1,2);
механизм карбидного цикла для Ni- и Fe-содержащих катализаторов, согласно которому образование кокса идет через карбидные соединения (1);
механизм компенсированного распада углеводородов на платине, предложенный сотрудниками Института катализа СО РАН Р.А. Буяновым и В.В. Чесноковым (3). Идея механизма компенсированного распада возникла при проведении Борониным А.И.(4,5)(,) экспериментов по разложению этилена на монокристалле платины. Эксперименты проводились на фотоэлектронном спектрометре VG ESCALAB HP. Кинетика отложения углерода регистрировалась в динамике по изменению отношения интенсивностей РФЭС сигналов C(1s) и Pt(4f) (4,5).
Цель данной работы - разработка кинетической модели, позволяющей:
на основе стадийного механизма качественно объяснить явления, наблюдаемые в эксперименте;
используя программу оптимизации, решить обратную задачу кинетики - найти такой набор констант скоростей элементарных стадий механизма, который позволяет количественно описать коксоотложение;
по данным, полученным при различных температурах, рассчитать энергии активации соответствующих стадий, выделить лимитирующие стадии процесса.
2. Анализ экспериментальных данных и построение модели
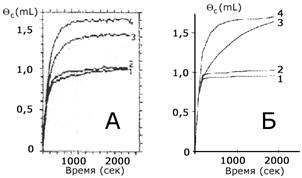
Рис. 1. Экспериментальные кривые коксонакопления (А) и смоделированные кривые (Б) в монослоях кокса при температурах: 1-770К, 2-870К, 3-895К, 4-920К
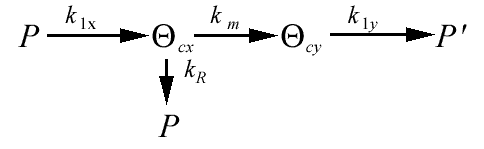
Рис. 2. Схема механизма компенсированного распада
Рис. 3. Схема механизма компенсированного распада
записанная через покрытия На рис. 1 представлены кинетические кривые коксонакопления при 770 - 920 K. Поскольку первые участки кривых имеют одинаковый наклон, можно предположить, что механизм отложения углерода, вероятно, один и тот же при небольшом значении покрытия внутри всего температурного интервала. При этом коксонакопление сильно зависит от температуры образца: при T < 870 K накопление происходит в пределах одного монослоя, но при T > 900 K значение cx становится равным 1,5 монослоя. Т.е. при низких температурах происходит хемосорбция углеводорода, а при высоких - образование связей C - C, что свидетельствует об образовании дегидрированного плотноупакованного углерода.
Для построения модели использовалась гипотеза об островковом образовании кокса (1).
Таким образом, на основании экспериментальных и литературных данных вполне вероятным может быть следующее феноменологическое представление механизма компенсированного распада: хемосорбированный углеводород проходит ряд промежуточных дегидрированных форм, внедряется в приповерхностный слой платины, мигрирует по поверхности (или диффундирует в объеме) и откладывается на поверхности в виде плотноупакованных структур, подобных графиту или алмазу. Появление именно такого - плотноупакованного, предельно дегидрированного углерода вызывает дезактивацию платины в катализаторах риформинга.
Схема механизма компенсированного распада представлена на рис. 2.
Ниже приводится та же схема, но записанная через покрытия:
где P, P' - углеводороды газовой фазы;
![]() - доля закоксованной (дезактивированной) поверхности типа X и Y, соответственно;
- доля закоксованной (дезактивированной) поверхности типа X и Y, соответственно;
k1x, k1y - константы скорости отложения монослоя кокса на активные поверхности типа X и Y, соответственно;
km, kR - константы скорости миграции и регенерации.
Общая система уравнений, описывающая механизм компенсированного распада: 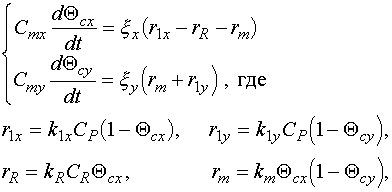
Cmx , Cmy - емкость монослоя для центров типа X, Y, соответственно (г/гкат);
![]() - коксуемость для X, Y - центров, соответственно (г/моль), причем со временем состав кокса не меняется, т.е.
- коксуемость для X, Y - центров, соответственно (г/моль), причем со временем состав кокса не меняется, т.е. ![]() ;
;
CP - концентрация углеводорода;
CR - концентрация регенерирующего агента в газовой фазе.
Поскольку полный анализ общей системы уравнений является предметом последующей публикации, здесь ограничимся лишь рассмотрением частного случая кинетической модели - коксоотложением с учетом миграции.
Пусть скорость миграции определяется только долей свободных мест на Y-поверхности. Тогда скорость миграции rm = km( 1 - Y ), и система уравнений для X и Y решается аналитически. Общая система уравнений для случая дезактивации с учетом миграции имеет вид (для удобства обозначим![]() :
:
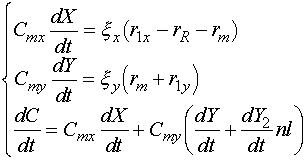 :
:
где Y2 - доля поверхности типа Y, занятая n > 1 слоями кокса.
3. Результаты и обсуждение
Для описания экспериментальных данных коксонакопления от времени использовано уравнение кинетической модели, отвечающее зависимости C = f ( t ). С помощью программы оптимизации решена обратная задача кинетики, т.е. найден такой набор констант скоростей элементарных стадий механизма, который позволяет количественно описать коксоотложение для интервала температур 770 - 920 K.
Графическое сопоставление экспериментальных и модельных кинетических кривых показано на рис. 1. Ошибка описания (6%) не превышает экспериментальной. При использовании классической Аррениусовской зависимости были рассчитаны энергии активации элементарных стадий процесса коксообразования при температурах 770 - 920 K:
| параметр | A | R | B2 | M | B | nl |
| Eакт,кДж/моль | 7 | 20 | 33 | 89 | 154 | 50 |
Каждая из этих констант характеризует определенную стадию коксообразования:
A - отложение углеводорода из газовой фазы;
R - регенерация;
B2 - образование 1-го слоя;
M - миграция (или диффузия);
B - нуклеация;
nl - образование слоев выше 1-го.
Из анализа данных видно, что энергия активации стадии отложения углеводорода из газовой фазы сопоставима с энергией активации адсорбции, а высокое значение энергии активации стадии нуклеации (зародышеобразования) говорит о том, что эта стадия - лимитирующая. При этом не нулевые значения этой константы соответствуют T900 K, что свидетельствует об образовании плотноупакованного углерода лишь при высоких температурах.
Список литературы
Буянов Р.А. Закоксование катализаторов. Новосибирск: Наука, 1983.
Реутова О.А., Островский Н.М. // Известия вузов. Химия и химическая технология. 1993. Т. 36. Вып. 7. С. 64.
Чесноков В.В. // Кинетика и катализ. 1991. Т.32. Вып.6. С. 1494.
Боронин А.И. // Изв. СО РАН СССР. Сер. хим. 1990. Вып. 2. С. 75.
Боронин А.И. // Изв. СО РАН СССР. Сер. хим. 1990. Вып. 2. С. 79.