Роль материнского генома в развитии потомка
Вступление
Со времени обнаружения в митохондриях молекул ДНК прошло четверть ве-ка, прежде чем ими заинтересовались не только молекулярные биологи и цито-логи, но и генетики, эволюционисты, а также палеонтологи и криминалисты. Такой широкий интерес спровоцировала работа А.Уилсона из Калифорнийско-го университета. В 1987 г. он опубликовал результаты сравнительного анализа ДНК митохондрий, взятых у 147 представителей разных этносов всех человече-ских рас, заселяющих пять континентов. По типу, местоположению и количес-тву индивидуальных мутаций установили, что все митохондриальные ДНК воз-никли из одной предковой последовательности нуклеотидов путем диверген-ции. В околонаучной прессе вывод этот интерпретировали крайне упрощенно — все человечество произошло от одной женщины, названной митохондриаль-ной Евой (т.к. и дочери и сыновья получают митохондрии только от матери), которая жила в Северо-Восточной Африке около 200 тыс. лет назад. Еще через 10 лет удалось расшифровать фрагмент ДНК митохондрий, выделенный из ос-танков неандертальца, и оценить время существования последнего общего предка человека и неандертальца в 500 тыс. лет назад.
Сегодня митохондриальная генетика человека интенсивно развивается как в популяционном, так и в медицинском аспекте. Установлена связь между рядом тяжелых наследственных заболеваний и дефектами в митохондриальных ДНК. Генетические изменения, ассоциированные со старением организма, наиболее выражены в митохондриях. Что же представляет из себя геном митохондрий, отличающийся у человека и других животных от такового у растений, грибов и простейших и по размеру, и по форме, и по генетической емкости? Какова роль, как работает и как возник митохондриальный геном у разных таксонов в целом и у человека в частности? Об этом и пойдет речь в моем “маленьком и самом скромном” реферате.
У всех эвкариот — будь это малярийный плазмодий, мельчайший одноклето-чный паразит, разрушающий эритроциты человека, или сам человек, гигантская свободноживущая клетка амеба протей, микроскопическая колония дрожжей или гриб, имеющий многокилометровый мицелий, эфемерные насекомые поде-нки или тысячелетние секвойи — у всех генетическая информация содержится не только в хромосомах клеточного ядра, но и в митохондриях — само-воспроизводящихся полуавтономных органеллах клетки, имеющих собствен-ный геном. В то время как ядерный геном представляет собой совокупность линейных молекул ДНК гаплоидного набора хромосом, митохондриальный ге-ном — одну или несколько кольцевых(редко линейных)молекул ДНК (мтДНК). В исключительных случаях эвкариотические клетки не содержат митохондрий, например некоторые паразитирующие в кишечнике анаэробные амебы.
В матриксе митохондрий, кроме ДНК, находятся и собственные рибосомы, по многим характеристикам отличающиеся от эвкариотических рибосом, рас-положенных на мембранах эндоплазматической сети. Однако на рибосомах ми-тохондрий образуется не более 5% от всех белков, входящих в их состав. Бóль-шая часть белков, составляющих структурные и функциональные компоненты митохондрий, кодируется ядерным геномом, синтезируется на рибосомах эндо-плазматической сети и транспортируется по ее каналам к месту сборки. Таким образом, митохондрии — это результат объединенных усилий двух геномов и двух аппаратов транскрипции и трансляции. Некоторые субъединичные ферме-нты дыхательной цепи митохондрий состоят из разных полипептидов, часть ко-торых кодируется ядерным, а часть — митохондриальным геномом. Например, ключевой фермент окислительного фосфорилирования — цитохром-с-оксидаза у дрожжей состоит из трех субъединиц, кодируемых и синтезируемых в мито-хондриях, и четырех, кодируемых в ядре клетки и синтезируемых в цитоплазме. Экспрессией большинства генов митохондрий управляют определенные гены ядер.
Симбиотическая теория происхождения митохондрий
Гипотезу о происхождении митохондрий и растительных пластид из вну-триклеточных бактерий-эндосимбионтов высказал Р.Альтман еще в 1890 г. За век бурного развития биохимии, цитологии, генетики и появившейся полвека назад молекулярной биологии гипотеза переросла в теорию, основанную на бо-льшом фактическом материале. Суть ее такова: с появлением фотосинтезирую-щих бактерий в атмосфере Земли накапливался кислород — побочный продукт их метаболизма. С ростом его концентрации усложнялась жизнь анаэробных ге-теротрофов, и часть из них для получения энергии перешла от бескислородного брожения к окислительному фосфорилированию. Такие аэробные гетеротрофы могли с бóльшим КПД, чем анаэробные бактерии, расщеплять органические ве-щества, образующиеся в результате фотосинтеза. Часть свободно живущих аэ-робов была захвачена анаэробами, но не “переварена”, а сохранена в качестве энергетических станций, митохондрий. Не стоит рассматривать митохондрии как рабов, взятых в плен, чтобы снабжать молекулами АТФ не способные к ды-ханию клетки. Они скорее “существа”, еще в протерозое нашедшие для себя и своего потомства лучшее из убежищ, где можно затрачивать наименьшие уси-лия, не подвергаясь риску быть съеденными.
В пользу симбиотической теории говорят многочисленные факты:
— совпадают размеры и формы митохондрий и свободно живущих аэробных бактерий; те и другие содержат кольцевые молекулы ДНК, не связанные с гистонами (в отличие от линейных ядерных ДНК);
— по нуклеотидным последовательностям рибосомные и транспортные РНК митохондрий отличаются от ядерных, демонстрируя при этом удивительное сходство с аналогичными молекулами некоторых аэробных грамотрицательных эубактерий;
— митохондриальные РНК-полимеразы, хотя и кодируются в ядре клетки, ингибируются рифампицином, как и бактериальные, а эвкариотические РНК-полимеразы нечувствительны к этому антибиотику;
— белковый синтез в митохондриях и бактериях подавляется одними и теми же антибиотиками, не влияющими на рибосомы эвкариот;
— липидный состав внутренней мембраны митохондрий и бактериальной плазмалеммы сходен, но сильно отличается от такового наружной мембраны митохондрий, гомологичной другим мембранам эвкариотических клеток;
— кристы, образуемые внутренней митохондриальной мембраной, являются эволюционными аналогами мезосомных мембран многих прокариот;
— до сих пор сохранились организмы, имитирующие промежуточные формы на пути к образованию митохондрий из бактерий (примитивная амеба Pelomyxa не имеет митохондрий, но всегда содержит эндосимбиотические бактерии).
Существует представление, что разные царства эвкариот имели разных предков и эндосимбиоз бактерий возникал на разных этапах эволюции живых организмов. Об этом же говорят отличия в строении митохондриальных гено-мов простейших, грибов, растений и высших животных. Но во всех случаях ос-новная часть генов из промитохондрий попала в ядро, возможно, с помощью мобильных генетических элементов. При включении части генома одного из симбионтов в геном другого интеграция симбионтов становится необратимой. Новый геном может создавать метаболические пути, приводящие к образова-нию полезных продуктов, которые не могут быть синтезированы ни одним из партнеров по отдельности. Так, синтез стероидных гормонов клетками коры надпочечников представляет собой сложную цепь реакций, часть которых происходит в митохондриях, а часть — в эндоплазматической сети. Захватив гены промитохондрий, ядро получило возможность надежно контролировать функции симбионта. В ядре кодируются все белки и синтез липидов наружной мембраны митохондрий, большинство белков матрикса и внутренней мембраны органелл. Самое главное, что ядро кодирует ферменты репликации, транскрип-ции и трансляции мтДНК, контролируя тем самым рост и размножение мито-хондрий. Скорость роста партнеров по симбиозу должна быть приблизительно одинаковой. Если хозяин будет расти быстрее, то с каждым его поколением число симбионтов, приходящихся на одну особь, будет уменьшаться, и, в конце концов, появятся потомки, не имеющие митохондрий. Мы знаем, что в каждой клетке организма, размножающегося половым путем, содержится много мито-хондрий, реплицирующих свои ДНК в промежутке между делениями хозяина. Это служит гарантией того, что каждая из дочерних клеток получит по крайней мере одну копию генома митохондрии.
Роль клеточного ядра в биогенезе митохондрий
У мутантных дрожжей определенного типа имеется обширная делеция в митохондриальной ДНК, что ведет к полному прекращению белкового синтеза в митохондриях; в результате эти органеллы не способны выполнять, свою функцию. Так как при росте на среде с низким содержанием глюкозы такие мутанты образуют мелкие колонии, их называют цитоплазматическими мутантами petite.
Хотя у мутантов petite нет митохондриального синтеза белков и поэтому нормальных митохондрий не образуется, тем не менее такие мутанты содержат промитохондрии, которые в известной мере сходны с обычными митохондриями, имеют нормальную наружную мембрану и внутреннюю мeмбрану со слабо развитыми кристами. В промитохондриях имеются многие ферменты, кодируемые ядерными генами и синтезируемые на рибосомах цитоплазмы, в том числе ДНК- и РНК-полимеразы, все ферменты цикла лимонной кислоты и многие белки, входящие в состав внутренней мембраны. Это наглядно демонстрирует преобладающую роль ядерного генома в биогенезе митохондрий.
Интересно отметить, что, хотя утраченные фрагменты ДНК составляют от 20 до более чем 99,9% митохондриального генома, общее количество митохондриальной ДНК у мутантов petite всегда остается на том же уровне, что и у дикого типа. Это обусловлено еще мало изученным процессом aмплификации ДНК, в результате которого образуется молекула ДНК, состоящая из тандемных повторов одного и того же участка и равная по величине нормальной молекуле. Например, митохондриальная ДНК мутанта petite, сохранившая 50% нуклеотидной последовательности ДНК дикого типа, будет состоять из двух повторов, тогда как молекула, сохранившая только 0,1% генома дикого типа, будет построена из 1000 копий оставшегося фрагмента. Таким образом, мутанты petite могут быть использованы для получения в большом количестве определенных участков митохондриальной ДНК, которые, можно сказать, клонируются самой природой.
Хотя биогенез органелл контролируется главным образом ядерными генами, сами органеллы тоже, судя по некоторым данным, оказывают какое-то регулирующее влияние по принципу обратной связи; во всяком случае так обстоит дело с митохондриями. Если блокировать синтез белка в митохондриях интактных клеток, то в цитоплазме начинают в избытке образовываться ферменты участвующие в митохондриальном синтезе ДНК, РНК и белков, как будто клетка пытается преодолеть воздействие блокирующего агента. Но, хотя существование какого-то сигнала со стороны митохондрий и не вызывает сомнений, природа его до сих пор не известна.
По ряду причин механизмы биогенеза митохондрий изучают сейчас в большинстве случаев на культурах Saccharomycescarlsbergensis(пивные дрожжи и S. cerevisiae(пекарские дрожжи). Во-первых, при росте на глюкозе эти дрожжи обнаруживают уникальную способность существовать только за счет гликолиза, т.е. обходиться без функции митохондрий. Это дает возможность изучать мутации в митохондриальной и ядерной ДНК, препятствующие развитию этих органелл. Такие мутации летальны почти у всех других организмов. Во-вторых, дрожжи - простые одноклеточные эукариоты- легко культивировать и подвергать биохимическому исследованию. И наконец, дрожжи могут размножаться как в гаплоидной, так и в диплоидной фазе, обычно бесполым способом-почкованием (асимметричный митоз). Но у дрожжей встречается и половой процесс: время от времени две гаплоидные клетки сливаются, образуя диплоидную зиготу, которая затем либо делится путем митоза, либо претерпевает мейоз и снова дает гаплоидные клетки. Контролируя в ходе эксперимента чередование бесполого и полового раз-множения, можно многое узнать о генах, ответственных за функцию митохондрий. С помощью этих методов можно, в частности, выяснить, локализованы ли такие гены в ядерной ДНК или в митохондриальной, так как мутации митохондриальных генов не наследуются по законам Менделя, которым подчиняется наследование ядерных генов.
Транспортные системы митохондрий
Большая часть белков, содержащихся в митохондриях и хлоропластах импор-тируется в эти органеллы из цитозоля. В связи с этим возникают два вопроса: как клетка направляет белки к надлежащей органелле и каким образом эти белки проникают в нее?
Частичный ответ был получен при изучении транспорта в строму хлоропласта малой субъединицы (S) фермента рибулозо-1,5-бисфосфат-карбоксилазы. Если мРНК, выделенную из цитоплазмы одноклеточной водоросли Chlamydomonasили из листьев гороха, ввести в качестве матрицы в белоксинтезирующую систему in vitro, то один из многих образующихся белков будет связываться специфическим анти-S-антителом. S-белок, синтезируемый in vitro, называют пpo-S, так как он больше обычного S-белка примерно на 50 аминокислотных остатков. При инкубации белка пpo-S с интактными хлоропластами он проникает в органеллы и превращается там под действием пептидазы в S-белок. Затем S-белок связывается с большой субъединицей рибулозо-1,5-бисфосфат-карбоксилазы, синтезируемой на рибосомах хлоропласта, и образует с нею в строме хлоропласта активный фермент.
Механизм переноса S-белка неизвестен. Полагают, что пpo-S связывается с белком-рецептором, находящимся на наружной мембране хлоропласта или в месте контакта наружной и внутренней мембран, а затем переносится в строму через трансмембранные каналы в результате процесса, требующего затраты энергии.
Сходным образом осуществляется транспорт белков внутрь митохондрий. Если очищенные митохондрии дрожжей инкубировать с клеточным экстрактом, содержащим только что синтезированные радиоактивные дрожжевые белки, то можно наблюдать, что митохондриальные белки, кодируемые ядерным геномом, отделяются от немитохондриальных белков цитоплазмы и избирательно включаются в митохондрии-так же, как это происходит в интактной клетке. При этом белки наружной и внутренней мембран, матрикса и межмембранного пространства находят свой путь к соответствующему компартменту митохондрии.
Многие из вновь синтезированных белков, предназначенных для внутренней мембраны, матрикса и межмембранного пространства, имеют на своем N-конце лидерный пептид, который во время транспортировки отщепляется специфической протеазой, находящейся в матриксе. Для переноса белков в эти три митохондриальных компартмента необходима энергия электрохимического протонного градиента, создаваемого на внутренней мембране. Механизм переноса белков для наружной мембраны иной: в этом случае не требуется ни затрат энергии, ни протеолитического расщепления более длинного белка-предшественника. Эти и другие наблюдения позволяют думать, что все четыре группы митохондриальных белков транспортируются в органеллу с помощью следующего механизма: предполагается, что все белки, кроме тех, которые предназначены для наружной мембраны, включаются во внутреннюю мембрану в результате процесса, требующего затраты энергии и происходящего в местах контакта наружной и внутренней мембран. По-видимому, после этого первоначального включения белка в мембрану он подвергается протеолитическому расщеплению, которое приводит к изменению его конформации; в зависимости от того, как изменится конформация, белок либо закрепляется в мембране, либо «выталкивается» в матрикс или в межмембранное пространство.
Перенос белков через мембраны митохондрий и хлоропластов в принципе аналогичен переносу их через мембраны эндоплазматического ретикулума. Однако здесь есть несколько важных отличий. Во-первых, при транспорте в матрикс или строму белок проходит как через наружную, так и через внутреннюю мембрану органеллы, тогда как при переносе в просвет эндоплазматического ретикулума молекулы проходят только через одну мембрану. Кроме того, перенос белков в ретикулум осуществляется с помощью механизма направленного выведения (vectorial discharge)-он начинается тогда, когда белок еще не полностью сошел с рибосомы (котрансляционный импорт), а перенос в митохондрии и хлоропласты происходит уже после того, как синтез белковой молекулы будет полностью завершен (посттрансляционный импорт).
Несмотря на эти различия, и в том и в другом случае клетка синтезирует белки-предшественники, содержащие сигнальную последовательность, которая определяет, к какой мембране направится данный белок. По-видимому, во многих случаях эта последовательность отщепляется от молекулы-предшественника после завершения транспортного процесса. Однако некоторые белки сразу синтезируются в окончательном виде. Полагают, что в таких случаях сигнальная последовательность заключена в полипептидной цепи готового белка. Сигнальные последовательности еще плохо изучены, но, вероятно, должно быть несколько типов таких последовательностей, каждый из которых определяет перенос белковой молекулы в определенную область клетки. Например, в растительной клетке некоторые из белков, синтез которых начинается в цитозоле, транспортируются затем в митохондрии, другие - в хлоропласты, третьи - в пероксисомы, четвертые - в эндоплазматический ретикулум. Сложные процессы, приводящие к правильному внутриклеточному распределению белков, только сейчас становятся понятными.
Помимо нуклеиновых кислот и белков для построения новых митохондрий нужны липиды. В отличие от хлоропластов митохондрии получают бóльшую часть своих липидов извне. В животных клетках фосфолипиды, синтезированные в эндоплазматическом ретикулуме, транспортируются к наружной мембране митохондрий с помощью особых белков, а затем включаются во внутреннюю мембрану; как полагают, это происходит в месте контакта двух мембран. Основная реакция биосинтеза липидов, катализируемая самими митохондриями, - это превращение фосфатидной кислоты в фосфолипид кардиолипин, который содержится главным образом во внутренней митохондриальной мембране и составляет около 20% всех ее липидов.
Размеры и форма митохондриальных геномов
К настоящему времени прочитано более 100 разных геномов митохондрий. На-бор и количество их генов в митохондриальных ДНК, для которых полностью определена последовательность нуклеотидов, сильно различаются у разных ви-дов животных, растений, грибов и простейших. Наибольшее количество генов обнаружено в митохондриальном геноме жгутикового простейшего Rectinomo-nas americana — 97 генов, включая все кодирующие белок гены, найденные в мтДНК других организмов. У большинства высших животных геном митохон-дрий содержит 37 генов: 13 для белков дыхательной цепи, 22 для тРНК и два для рРНК (для большой субъединицы рибосом 16S рРНК и для малой 12S рРНК). У растений и простейших, в отличие от животных и большинства гри-бов, в митохондриальном геноме закодированы и некоторые белки, входящие в состав рибосом этих органелл. Ключевые ферменты матричного полинуклеоти-дного синтеза, такие как ДНК-полимераза (осуществляющая репликацию мито-хондриальной ДНК) и РНК-полимераза (транскрибирующая геном митохон-дрий), зашифрованы в ядре и синтезируются на рибосомах цитоплазмы. Этот факт указывает на относительность автономии митохондрий в сложной иерар-хии эвкариотической клетки.
Геномы митохондрий разных видов отличаются не только по набору ге-нов, порядку их расположения и экспрессии, но по размеру и форме ДНК. По-давляющее большинство описанных сегодня митохондриальных геномов пред-ставляет собой кольцевые суперспирализованные двуцепочечные молекулы ДНК. У некоторых растений наряду с кольцевыми формами имеются и линей-ные, а у некоторых простейших, например инфузорий, в митохондриях обнару-жены только линейные ДНК.
Как правило, в каждой митохондрии содержится несколько копий ее ге-нома. Так, в клетках печени человека около 2 тыс. митохондрий, и в каждой из них — по 10 одинаковых геномов. В фибробластах мыши 500 митохондрий, со-держащих по два генома, а в клетках дрожжей S.cerevisiae — до 22 митохон-дрий, имеющих по четыре генома.
Митохондриальный геном растений, как правило, состоит из нескольких молекул разного размера. Одна из них, “основная хромосома”, содержит боль-шую часть генов, а кольцевые формы меньшей длины, находящиеся в динами-ческом равновесии как между собой, так и с основной хромосомой, образуются в результате внутри- и межмолекулярной рекомбинации благодаря наличию по-вторенных последовательностей (рис.1).
Рис 1. Схема образования кольцевых молекул ДНК разного размера в митохондриях растений. Рекомбинация происходит по повторенным участкам (обозначены синим цветом).
В митохондриях большинства организмов (кроме высших животных) часть кольцевых молекул ДНК присутствует в виде олигоме-ров, которые можно разделить на три класса: линейные; кольцевые, имеющие контурную длину, кратную длине мономерных колец; цепные, катенаны, состо-ящие из топологически связанных, т.е. продетых друг в друга, мономерных ко-лец (рис.2). Так, в единственной митохондрии простейших из отряда кинето-пластид, включающего эндопаразита человека — трипаносому, содержатся ты-сячи кольцевых молекул ДНК. У Trypanosoma brucei имеются два типа моле-кул: 45 одинаковых максиколец, каждое из которых состоит из 21 тыс. пар ну-клеотидов, и 5.5 тыс. идентичных друг другу миниколец по 1000 пар нуклео-тидов. Все они, соединяясь в катенаны, образуют переплетенную сеть, которая вместе с белками формирует структуру, называемую кинетопластом.
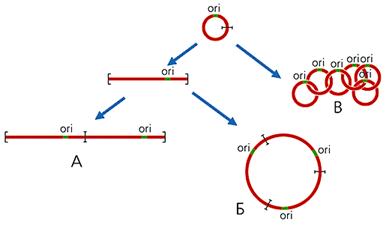 Рис 2. Схема образования линейных (А), кольцевых (Б), цепных (В) олигомеров мтДНК. ori — район начала репликации ДНК.
Рис 2. Схема образования линейных (А), кольцевых (Б), цепных (В) олигомеров мтДНК. ori — район начала репликации ДНК.
Размер генома митохондрий разных организмов колеблется от менее 6 тыс. пар нуклеотидов у малярийного плазмодия (в нем, помимо двух генов рРНК, содержится только три гена, кодирующих белки) до сотен тысяч пар ну-клеотидов у наземных растений (например, у Arabidopsis thaliana из семейства крестоцветных 366924 пар нуклеотидов). При этом 7—8-кратные различия в ра-змерах мтДНК высших растений обнаруживаются даже в пределах одного се-мейства. Длина мтДНК позвоночных животных отличается незначительно: у человека — 16569 пар нуклеотидов, у свиньи — 16350, у дельфина — 16330, у шпорцевой лягушки Xenopus laevis — 17533, у карпа — 16400. Эти геномы схо-дны также и по локализации генов, большинство которых располагаются встык; в ряде случаев они даже перекрываются, обычно на один нуклеотид, так что по-следний нуклеотид одного гена оказывается первым в следующем. В отличие от позвоночных, у растений, грибов и простейших мтДНК содержат до 80% не-кодирующих последовательностей. У разных видов порядок генов в геномах митохондрий отличается.
Высокая концентрация активных форм кислорода в митохондриях и сла-бая система репарации увеличивают частоту мутаций мтДНК по сравнению с ядерной на порядок. Радикалы кислорода служат причиной специфических за-мен Ц®Т (дезаминирование цитозина) и Г®Т (окислительное повреждение гуанина), вследствие чего, возможно, мтДНК богаты АТ-парами. Кроме того, все мтДНК обладают интересным свойством — они не метилируются, в отли-чие от ядерных и прокариотических ДНК. Известно, что метилирование (време-нная химическая модификация нуклеотидной последовательности без наруше-ния кодирующей функции ДНК) — один из механизмов программируемой инактивации генов.
Размеры и строение молекул ДНК в органеллах
Вид | Структура | Масса, млн. дальтон | Примечания | |
Мит охон дриа льн ая Д Н К | Животные | Кольцевая | 9-12 | У каждого отдельного вида все молекулы одного размера |
Высшие ра стения | Кольцевая | Варьирует | У всех изученных видов имеются разные по величине кольцевые ДНК, в которых общее содержание генетической информации соответ-ствует массе от 300 до 1000 млн. дальтон в зависимости от вида | |
Грибы: Saccharomyces Kluyveromyces Простейшие Plasmodium Paramecium | Кольцевая Кольцевая Кольцевая Линейная | 50 22 18 27 | ||
Д Н К Хлор опла стов | Водоросли Chlamydomonas Euglena | Кольцевая Кольцевая | 120 90 | |
Высшие растения | Кольцевая | 85-97 | У каждого отдельного вида найдены молекулы только одного размера | |
Относительное количество ДНК органелл в некоторых клетках и тканях
Организм | Ткань или тип клеток | Число мол-л ДНК/органел- лу | Число орга- нелл в клетке | Доля ДНК орга-нелл во всей ДНК клетки, % | |
Мит охон дриа льн ая Д Н К | Крыса | Печень | 5-10 | 1000 | 1 |
| Мышь | Клетки линии L | 5-10 | 100 | <1 | |
| Лягушка | Яйцеклетка | 5-10 | 107 | 99 | |
| Дрожжи | Вегетативные диплоидные клетки | 2-50 | 2-50 | 15 | |
Д Н К Хлор опла стов | Chlamydomonas | Вегетативные диплоидные клетки | 80 | 2 | 7 |
| Кукуруза | Листья | 20-40 | 20-40 | 15 | |
Функционирование митохондриального генома
Что же особенного в механизмах репликации и транскрипции ДНК митохондрий млекопитающих?
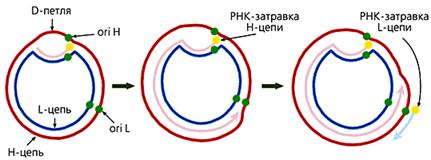 У большинства животных комплементарные цепи в мтДНК значительно различаются по удельной плотности, поскольку содержат неодинаковое количе-ство “тяжелых” пуриновых и “легких” пиримидиновых нуклеотидов. Так они и называются — H (heavy — тяжелая) и L (light — легкая) цепь. В начале репли-кации молекулы мтДНК образуется так называемая D-петля (от англ. Displace-ment loop — петля смещения). Эта структура, видимая в электронный микро-скоп, состоит из двуцепочечного и одноцепочечного (отодвинутой части Н-цепи) участков. Двуцепочечный участок формируется частью L-цепи и компле-ментарным ей вновь синтезированным фрагментом ДНК длиной 450—650 (в зависимости от вида организма) нуклеотидов, имеющим на 5'-конце рибонук-леотидную затравку, которая соответствует точке начала синтеза Н-цепи (oriH). Синтез L-цепи начинается лишь тогда, когда дочерняя Н-цепь доходит до точки ori L. Это обусловлено тем, что область инициации репликации L-цепи доступ-на для ферментов синтеза ДНК лишь в одноцепочечном состоянии, а следовате-льно, только в расплетенной двойной спирали при синтезе Н-цепи. Таким обра-зом, дочерние цепи мтДНК синтезируются непрерывно и асинхронно (рис.3).
У большинства животных комплементарные цепи в мтДНК значительно различаются по удельной плотности, поскольку содержат неодинаковое количе-ство “тяжелых” пуриновых и “легких” пиримидиновых нуклеотидов. Так они и называются — H (heavy — тяжелая) и L (light — легкая) цепь. В начале репли-кации молекулы мтДНК образуется так называемая D-петля (от англ. Displace-ment loop — петля смещения). Эта структура, видимая в электронный микро-скоп, состоит из двуцепочечного и одноцепочечного (отодвинутой части Н-цепи) участков. Двуцепочечный участок формируется частью L-цепи и компле-ментарным ей вновь синтезированным фрагментом ДНК длиной 450—650 (в зависимости от вида организма) нуклеотидов, имеющим на 5'-конце рибонук-леотидную затравку, которая соответствует точке начала синтеза Н-цепи (oriH). Синтез L-цепи начинается лишь тогда, когда дочерняя Н-цепь доходит до точки ori L. Это обусловлено тем, что область инициации репликации L-цепи доступ-на для ферментов синтеза ДНК лишь в одноцепочечном состоянии, а следовате-льно, только в расплетенной двойной спирали при синтезе Н-цепи. Таким обра-зом, дочерние цепи мтДНК синтезируются непрерывно и асинхронно (рис.3).
Рис 3. Схема репликации мтДНК млекопитающих. Сначала формируется D-петля, затем синтезируется дочерняя Н-цепь, потом начинается синтез дочерней L-цепи.
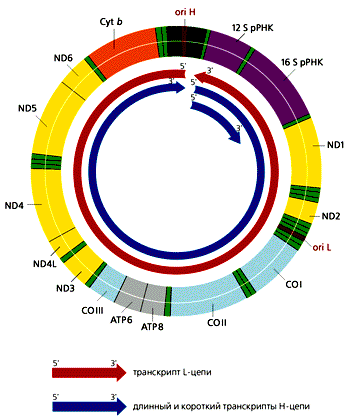 В митохондриях общее число молекул с D-петлей значительно превыша-ет число полностью реплицирующихся молекул. Обусловлено это тем, что у D-петли есть дополнительные функции — прикрепление мтДНК к внутренней ме-мбране и инициация транскрипции, поскольку в этом районе локализованы промоторы транскрипции обеих цепей ДНК. В отличие от большинства эв-кариотических генов, которые транскрибируются независимо друг от друга, ка-ждая из цепей мтДНК млекопитающих переписывается с образованием одной молекулы РНК, начинающейся в районе ori H. Помимо этих двух длинных мо-лекул РНК, комплементарных Н- и L-цепям, формируются и более короткие участки Н-цепи, которые начинаются в той же точке и заканчиваются на 3'-кон-це гена 16S рРНК (рис.4). Таких коротких транскриптов в 10 раз больше, чем длинных. В результате созревания (процессинга) из них образуются 12S рРНК и 16S рРНК, участвующие в формировании митохондриальных рибосом, а так-же фенилаланиновая и валиновая тРНК. Из длинных транскриптов вырезаются остальные тРНК и образуются транслируемые мРНК, к 3'-концам которых при-соединяются полиадениловые последовательности. 5'-концы этих мРНК не кэ-пируются, что необычно для эвкариот. Сплайсинга (сращивания) не происхо-дит, поскольку ни один из митохондриальных генов млекопитающих не содер-жит интронов.
В митохондриях общее число молекул с D-петлей значительно превыша-ет число полностью реплицирующихся молекул. Обусловлено это тем, что у D-петли есть дополнительные функции — прикрепление мтДНК к внутренней ме-мбране и инициация транскрипции, поскольку в этом районе локализованы промоторы транскрипции обеих цепей ДНК. В отличие от большинства эв-кариотических генов, которые транскрибируются независимо друг от друга, ка-ждая из цепей мтДНК млекопитающих переписывается с образованием одной молекулы РНК, начинающейся в районе ori H. Помимо этих двух длинных мо-лекул РНК, комплементарных Н- и L-цепям, формируются и более короткие участки Н-цепи, которые начинаются в той же точке и заканчиваются на 3'-кон-це гена 16S рРНК (рис.4). Таких коротких транскриптов в 10 раз больше, чем длинных. В результате созревания (процессинга) из них образуются 12S рРНК и 16S рРНК, участвующие в формировании митохондриальных рибосом, а так-же фенилаланиновая и валиновая тРНК. Из длинных транскриптов вырезаются остальные тРНК и образуются транслируемые мРНК, к 3'-концам которых при-соединяются полиадениловые последовательности. 5'-концы этих мРНК не кэ-пируются, что необычно для эвкариот. Сплайсинга (сращивания) не происхо-дит, поскольку ни один из митохондриальных генов млекопитающих не содер-жит интронов.
ND1—ND6, ND4L — гены субъединиц НAД-H-дегидрогеназного комплекса; СОI—COIII — гены субъединиц цитохром-с-оксидазы; ATP6, ATP8 — гены субъединиц AТФ-синтетазы Cyt b — ген цитохрома b. |
Рис 4. Транскрипция мтДНК человека, содержащей 37 генов. Все транскрипты начинают синтезироваться в районе ori H. Рибосомные РНК вырезаются из длинного и короткого транскриптов Н-цепи. тРНК и мРНК образуются в результате процессинга из транскриптов обеих цепей ДНК. Гены тРНК обозначены светло-зеленым цветом.
Хотите узнать какие еще сюрпризы способен преподнести митохон-дриальный геном? Отлично! Читаем дальше!..
Несмотря на то, что в геномах митохондрий млекопитающих и дрожжей содержится приблизительно одинаковое количество генов, размеры дрожжево-го генома в 4-5 раз больше — около 80 тыс. пар нуклеотидов. Хотя кодирую-щие последовательности мтДНК дрожжей высоко гомологичны соответствую-щим последовательностям у человека, дрожжевые мРНК дополнительно имеют 5'-лидерную и 3'-некодирующую области, как и большинство ядерных мРНК. Ряд генов содержит еще и интроны. Так, в гене box, кодирующем цитохром-оксидазу b, имеется два интрона. Из первичного РНК-транскрипта автокатали-тически (без участия каких-либо белков) вырезается копия большей части пер-вого интрона. Оставшаяся РНК служит матрицей для образования фермента ма-туразы, участвующей в сплайсинге. Часть ее аминокислотной последовательно-сти закодирована в оставшихся копиях интронов. Матураза вырезает их, разру-шая свою собственную мРНК, копии экзонов сшиваются, и образуется мРНК для цитохромоксидазы b (рис.5). Открытие такого феномена заставило пере-смотреть представление об интронах, как о “ничего не кодирующих последова-тельностях”.
Рис 5. Процессинг (созревание) мРНК цитохромоксидазы b в митохондриях дрожжей. На первом этапе сплайсинга образуется мРНК, по которой синтезируется матураза, необходимая для второго этапа сплайсинга.
При изучении экспрессии митохон-дриальных генов Trypanosoma brucei обнаружилось удивительное отклонение от одной из основных аксиом молекулярной биологии, гласящей, что после-довательность нуклеотидов в мРНК в точности соответствует таковой в коди-рующих участках ДНК. Оказалось, мРНК одной из субъединиц цитохром-с-оксидазы редактируется, т.е. после транскрипции изменяется ее первичная структура — вставляется четыре урацила. В результате образуется новая мРНК, служащая матрицей для синтеза дополнительной субъединицы фермента, пос-ледовательность аминокислот в которой не имеет ничего общего с последова- тельностью, кодируемой нередактированной мРНК (см. таблицу).
тельностью, кодируемой нередактированной мРНК (см. таблицу).
Происходит это за счет сдвига рамки считыва-ния на число нуклеотидов, не кратное размеру триплета (в данном случае на четыре). Новая белковая субъединица, необходимая для работы фермента, об-разуется в митохондриях паразита только тогда, когда он попадает в организм холоднокровной мухи и нуждается в окислительном фосфорилировании для получения большого количества молекул АТФ. Если трипаносома живет в ор-ганизме теплокровных млекопитающих, ей достаточно АТФ, образующейся в процессе гликолиза. Впервые обнаруженное в митохондриях трипаносомы ре-дактирование РНК широко распространено в хлоропластах и митохондриях вы-сших растений. Найдено оно и в соматических клетках млекопитающих, напри-мер, в кишечном эпителии человека редактируется мРНК гена аполипопротеина.
Наибольший сюрприз ученым митохондрии преподнесли в 1979 г. До то-го времени считалось, что генетический код универсален и одни и те же трип-леты кодируют одинаковые аминокислоты у бактерий, вирусов, грибов, расте-ний и животных. Английский исследователь Беррел сопоставил структуру од-ного из митохондриальных генов теленка с последовательностью аминокислот в кодируемой этим геном субъединице цитохромоксидазы. Оказалось, что гене-тический код митохондрий крупного рогатого скота (как и человека) не просто отличается от универсального, он “идеален”, т.е. подчиняется следующему пра-вилу: “если два кодона имеют два одинаковых нуклеотида, а третьи нуклеоти-ды принадлежат к одному классу (пуриновых — А, Г, или пиримидиновых — У, Ц), то они кодируют одну и ту же аминокислоту”. В универсальном коде есть два исключения из этого правила: триплет АУА кодирует изолейцин, а кодон АУГ — метионин, в то время как в идеальном коде митохондрий оба эти трип-лета кодируют метионин; триплет УГГ кодирует лишь триптофан, а триплет УГА — стоп-кодон. В универсальном коде оба отклонения касаются прин-ципиальных моментов синтеза белка: кодон АУГ — инициирующий, а стоп-кодон УГА останавливает синтез полипептида. Идеальный код присущ не всем описанным митохондриям, но ни у одной из них нет универсального кода. Мож-но сказать, что митохондрии говорят на разных языках, но никогда — на языке ядра.
Различия между “универсальным” генетическим кодом и двумя митохондриальными кодами
Кодон | Митохондриальный код млекопитающих | Митохондриальный код дрожжей | “Универсальный” код |
UGA | Trp | Trp | Stop |
AUA | Met | Met | Ile |
CUA | Leu | Thr | Leu |
AGA AGG | Cmon | Arg | Arg |
Как уже говорилось, в митохондриальном геноме позвоночных есть 22 ге-на тРНК. Каким же образом такой неполный набор обслуживает все 60 кодонов для аминокислот (в идеальном коде из 64 триплетов четыре стоп-кодона, в уни-версальном — три)? Дело в том, что при синтезе белка в митохондриях упроще-ны кодон-антикодонные взаимодействия — для узнавания используется два из трех нуклеотидов антикодона. Таким образом, одна тРНК узнает все четыре представителя кодонового семейства, отличающиеся только третьим нуклеоти-дом. Например, лейциновая тРНК с антикодоном ГАУ встает на рибосоме на-против кодонов ЦУУ, ЦУЦ, ЦУА и ЦУГ, обеспечивая безошибочное включе-ние лейцина в полипептидную цепь. Два других лейциновых кодона УУА и УУГ узнаются тРНК с антикодоном ААУ. В целом, восемь разных молекул тРНК узнают восемь семейств по четыре кодона в каждом, и 14 тРНК узнают разные пары кодонов, каждая из которых шифрует одну аминокислоту.
Важно, что ферменты аминоацил-тРНК-си